


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:初中化学 来源: 题型:
(2012?泰安)下表是部分农作物生长对土壤pH的要求.如果某地区经常降酸雨,则该地区最不适合种植的农作物是( )
|
查看答案和解析>>
科目:初中化学 来源: 题型:
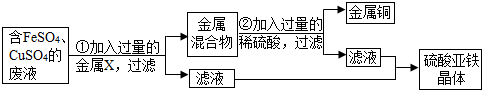
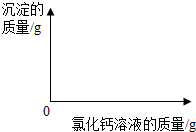 (2012?泰安)小明同学为了测定市面销售的某品牌纯碱(杂质为氯化钠)中碳酸钠的质量分数,进行了如下实验:①在三个烧杯中分别加入11.0g样品及足量的水配成溶液;②向三个烧杯中分别加入一定质量的10.0%氯化钙溶液;③将充分反应后生成的沉淀过滤、洗涤、干燥,并称量得到的白色固体.
(2012?泰安)小明同学为了测定市面销售的某品牌纯碱(杂质为氯化钠)中碳酸钠的质量分数,进行了如下实验:①在三个烧杯中分别加入11.0g样品及足量的水配成溶液;②向三个烧杯中分别加入一定质量的10.0%氯化钙溶液;③将充分反应后生成的沉淀过滤、洗涤、干燥,并称量得到的白色固体.| 烧杯Ⅰ | 烧杯Ⅱ | 烧杯Ⅲ | |
| 加入10.0%氯化钙溶液的质量(g) | 55.5 | 120.0 | 150.0 |
| 白色固体的质量(g) | 5.0 | 10.0 | 10.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com