
| A、AgNO3--AgCl | B、Cu--H2 | C、CuO--CuSO4 | D、CaCO3--CO2 |
| ||


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:初中化学 来源: 题型:阅读理解
| 实验步骤 | 实验现象 | 实验结论 |
| ①将易拉罐口打开,迅速用燃着的木条伸入罐口. | 发出“噗”的一声,产生淡蓝色火焰,片刻后熄灭. | 说明罐中重新生成的气体A是(2) 氢气(H2) 氢气(H2) . |
| ②取少量铝片于试管中,先加入适量的水,片刻后再加入少量的氢氧化钠溶液. | 先加水,没有明显变化,后加入氢氧化钠溶液后产生无色无味的气体. | 说明铝是否与水直接反应: 否 否 (3)(填“是”或“否”),铝能够与NaOH(碱性) NaOH(碱性) (4)溶液反应. |
| ③取少量易拉罐中反应后的溶液于试管中,加入过量的稀盐酸. | 产生了无色无味气体,该气体能使澄清石灰水变浑浊. | 说明原CO2气体被NaOH溶液吸收 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

| 紫色石蕊试液 | pH<5.0:红色 | 5.0<pH<8.0:紫色 | pH>8.0:蓝色 |
| 无色酚酞试液 | pH<8.2:无色 | 8.2<pH<10.0:红色 | pH>10.0:无色 |

| 温度/°C | 10 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 64 | 85 | 138 | 203 | 285 | 376 |
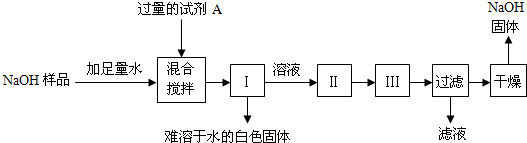
| 106 |
| x |
| 73 |
| y?7.3% |
| 44 |
| 2.2g |
| 13.5g-5.3g |
| 13.5g |

| 106 |
| x |
| 73 |
| y?7.3% |
| 44 |
| 2.2g |
| 13.5g-5.3g |
| 13.5g |


查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:初中化学 来源:2011年全国中考真题专题汇编专题五 探究题(二) 题型:探究题
(2011年湖南株洲,30题) 某学习小组在探究CO2与NaOH溶液反应的实验中,先用铝制易拉罐收集满一罐CO2气体,然后迅速向其中加入—定量的NaOH浓溶液,立即将易拉罐口封闭(不漏气),轻轻摇动易拉罐,发现易拉罐很快变瘪,但过一段时间后,易拉罐又重新鼓起来(反应过程中温度的变化忽略不计)。
(提出问题)易拉罐为什么先瘪后鼓?
(分析猜想)易拉罐开始时变瘪的原因是 (用化学方程式表示),
易拉罐重新鼓起的原因是易拉罐中又生成了气体A,其成分极有可能是CO2或H2。
(查阅资料)①Na2CO3具有较强的热稳定性,只有在高温条件下才会分解;
②铝单质比较容易被酸、碱腐蚀。
(设计方案并进行实验)为了检验铝制易拉罐中重新生成的气体成分,小组又进行如下实验,并记录了相应的实验现象:
| 实验步骤 | 实验现象 | 实验结论 |
| 将易拉罐口打开,迅速用燃着的木条伸入罐口。 | 发出“噗”的—声,产生淡蓝色火焰,片刻后熄灭。 | 说明罐中重新生成的气体A是 (2) |
| 取少量铝片于试管中,先加入适量的水,片刻后再加入少量的氢氧化钠溶液。 | 先加水,没有明显变化,后加入氢氧化钠溶液后产生无色无味的气体。 | 说明铝是否与水直接反应:(3)(填“是”或“否”),铝能够与 ⑷ 溶液反应。 |
| 取少量易拉罐中反应后的溶液于试管中,加入过量的稀盐酸。 | 产生了无色无味气体,该气体能使澄清石灰水变浑浊。 | 说明原CO2气体被NaOH溶液吸收 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
某学习小组在探究CO2与NaOH溶液反应的实验中,先用铝制易拉罐收集满一罐CO2气体,然后迅速向其中加入一定量的NaOH浓溶液,立即将易拉罐口封闭(不漏气),轻轻摇动易拉罐,发现易拉罐很快变瘪,但过一段时间后,易拉罐又重新鼓起来(反应过程中温度的变化忽略不计)。
【提出问题】易拉罐为什么先瘪后鼓?
【分析猜想】易拉罐开始时变瘪的原因是 (1) (用化学方程式表示),易拉罐重新鼓起的原因是易拉罐中又生成了气体A,其成分极有可能是CO2或 H2。
【查阅资料】①Na2CO3具有较强的热稳定性,只有在高温条件下才会分解;
②铝单质比较容易被酸、碱腐蚀。
【设计方案并进行实验】为了检验铝制易拉罐中重新生成的气体成分,小组又进行如下实验,并记录了相应的实验现象:
| 实验步骤 | 实验现象 | 实验结论 |
| ①将易拉罐口打开,迅速用燃着的木条伸入罐口。 | 发出“噗”的一声,产生淡蓝色火焰,片刻后熄灭。 | 说明罐中重新生成的气体A是 (2) 。 |
| ②取少量铝片于试管中,先加入适量的水,片刻后再加入少量的氢氧化钠溶液。 | 先加水,没有明显变化,后加入氢氧化钠溶液后产生无色无味的气体。 | 说明铝是否与水直接反应: (3) (填 “是”或“否”),铝能够与 (4) 溶液反应。 |
| ③取少量易拉罐中反应后的溶液于试管中,加入过量的稀盐酸。 | 产生了无色无味气体,该气体能使澄清石灰水变浑浊。 | 说明原CO2气体被NaOH溶液吸收 |
【实验结论】①铝制易拉罐变瘪的原因是CO2被NaOH溶液吸收,②铝制易拉罐重新鼓起的原因是铝与NaOH溶液反应产生了气体。
【反思评价】小组根据实验探究获得一条对金属铝化学性质的新认识: (5) 。
【拓展延伸】Al与NaOH溶液反应产生了气体的同时还生成另一种书写形式类似于KMnO4的盐,请完成下列反应化学方程式:2Al+2NaOH+2H2O= 2 (6) +3A↑。当然,本实验只是初步探究,还有进一步探究的价值,有待我们在以后的学习中去深究。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com