
| A、称量时,将固体NaCl放在天平左盘称量纸上 |
| B、蒸发操作中,玻璃棒的主要作用是加快蒸发 |
| C、主要操作步骤为:计算、称量、量取、溶解等 |
| D、量取时,视线与量筒内凹液面的最低点保持水平 |


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
| A、4Fe2+:4个铁离子 |
| B、N2O3:1个三氧化二氮分子 |
| C、Ca+2:显+2价的钙元素 |
| D、2H:1个氢分子由2个氢原子构成 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 选项 | 物质 | 杂质 | 所选试剂 |
| A | 铜粉 | 铁粉 | 稀盐酸 |
| B | 氢氧化钠溶液 | 碳酸钠 | 氯化钙溶液 |
| C | 二氧化碳 | 一氧化碳 | 浓氢氧化钠溶液 |
| D | 氯化亚铁溶液 | 氯化铜 | 铜 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:初中化学 来源: 题型:
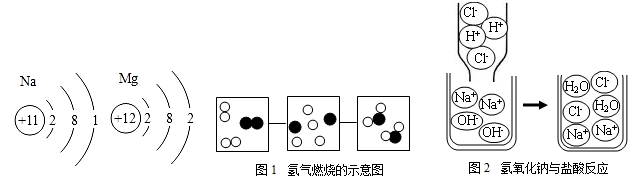
查看答案和解析>>
科目:初中化学 来源: 题型:
| 20℃时,一些物质的溶解度 | ||
| OH- | CO32- | |
| Na+ | 溶 | 溶 |
| Ca2+ | 微 | 不 |
| Mg2+ | 不 | 微 |
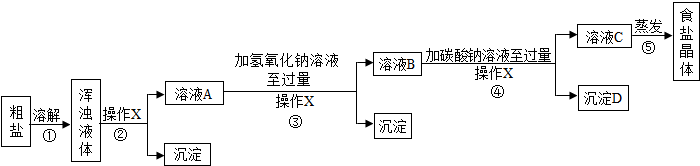
| 物质 | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
| 溶解度 | 36.0g | 9.6g | 37.2g | 710 | 0.9 |
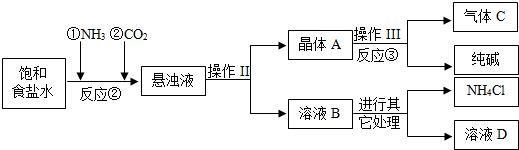
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com