

分析 (1)水果、蔬菜中含有丰富的维生素;
(2)根据信息推断生成物,利用质量守恒定律书写化学方程式;
(3)根据材料的分类知识分析;
(4)A、氧化物是只含有两种元素且其中一种元素是氧元素的化合物.
B、根据物质的构成与组成进行分析判断.
C、根据该兴奋剂化学式的含义进行分析判断.
D、根据一个该兴奋剂分子的构成进行分析判断.
解答 解:(1)冻干水果、脱水蔬菜中含有丰富的维生素.故填:BD.
(2)有题中信息:生成三种新物质,分别为空气中最多的气体成分和光合作用所需的两种物质,空气中最多的气体为氮气,光合作用需要二氧化碳和水,则该反应为:反应物为偏二甲肼和四氧化二氮生成氮气、二氧化碳和水,化学方程式为:C2H8N2+2N2O4$\frac{\underline{\;点燃\;}}{\;}$3N2+2CO2+4H2O;故填:C2H8N2+2N2O4$\frac{\underline{\;点燃\;}}{\;}$3N2+2CO2+4H2O;
(3)金、银、铜、铝合金、钢铁属于金属材料,故选:①②③;
(4)A、该兴奋剂是由碳、氢、氧三种元素组成的化合物,不属于氧化物,故选项说法错误.
B、该兴奋剂的一个分子是由多种原子构成的,故选项说法错误.
C、该兴奋剂是由碳、氢、氧三种元素组成的,故选项说法正确.
D、该兴奋剂中碳、氢、氧三种元素的质量比为:12×20:1×26:16×2=240:26:32=120:13:16,故选项说法错误.
故选:C.
点评 本题主要考查了化学方程式的书写及材料的分类方法等方面的内容,可以依据已有的知识进行.


科目:初中化学 来源: 题型:实验探究题
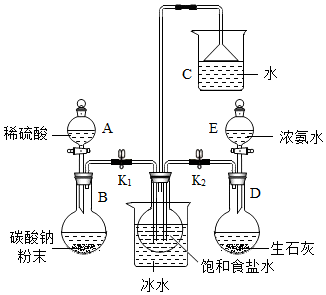
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
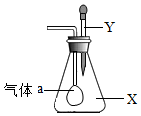 如图所示,锥形瓶内盛有气体X,滴管内盛有液体Y,若挤压滴管胶头,使液体Y滴入瓶中,振荡,一会儿可见小气球a鼓起.气体X和液体Y可能是( )
如图所示,锥形瓶内盛有气体X,滴管内盛有液体Y,若挤压滴管胶头,使液体Y滴入瓶中,振荡,一会儿可见小气球a鼓起.气体X和液体Y可能是( )| A. | X是CO2,Y是氢氧化钠 | B. | X是O2,Y是稀H2SO4(稀硫酸) | ||
| C. | X是N2,Y是稀盐酸 | D. | X是CO,Y是氢氧化钠 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 溶解度(g) | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | 168 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
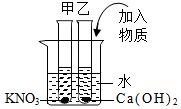 表为硝酸钾和氢氧化钙在不同温度下的溶解度.如图所示,甲、乙试管分别盛有20℃时硝酸钾、氢氧化钙的饱和溶液,试管底部均有未溶解的固体.现向烧杯内的水中加入某物质后,甲试管中固体消失,乙试管中固体增加,则加入的物质可能是( )
表为硝酸钾和氢氧化钙在不同温度下的溶解度.如图所示,甲、乙试管分别盛有20℃时硝酸钾、氢氧化钙的饱和溶液,试管底部均有未溶解的固体.现向烧杯内的水中加入某物质后,甲试管中固体消失,乙试管中固体增加,则加入的物质可能是( )| 温度(℃) | 10 | 20 | 40 | 60 | 80 |
| 氢氧化钙的质量(温度) | 0.173 | 0.165 | 0.121 | 0.120 | 0.095 |
| 硝酸钾的质量 | 13.3 | 31.6 | 63.9 | 110 | 169 |
| A. | 硝酸铵 | B. | 氢氧化钠 | C. | 蔗糖 | D. | 氯化钠 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
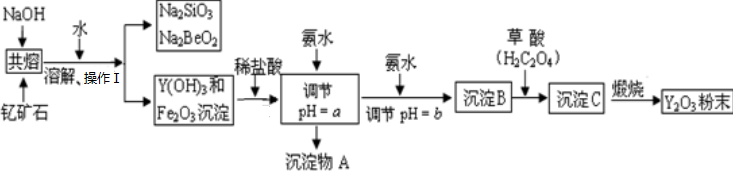
| 开始沉淀时的pH | 完全沉淀时的pH | |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. |  利用红磷燃烧测定空气中氧气的含量(打开止水夹前) | |
| B. |  将生锈严重的铁钉加入到足量的稀盐酸中 | |
| C. | 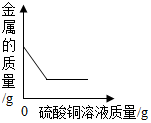 向一定量铁粉和铜粉混合物中加入硫酸铜溶液 | |
| D. |  将过量的等质量的镁和锌跟别加入到等质量、等质量分数的稀盐酸中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com