




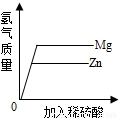
 产生氢气的速率与金属的活动性有关;
产生氢气的速率与金属的活动性有关; ,镁和锌都是+2价,金属的质量相等,镁的相对原子质量小于锌的相对原子质量,则镁生成的氢气质量大于锌生成的氢气的质量,故正确;
,镁和锌都是+2价,金属的质量相等,镁的相对原子质量小于锌的相对原子质量,则镁生成的氢气质量大于锌生成的氢气的质量,故正确;

 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:初中化学 来源:2012年山西省临汾三中中考化学模拟试卷(二)(解析版) 题型:选择题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com