
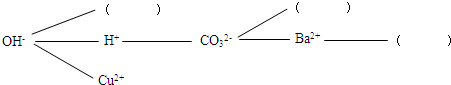
分析 【练习质疑】根据复分解反应发生的条件:生成物中有沉淀、气体或水生成,写出反应的化学方程式即可.
【研究讨论】复分解反应的实质是:发生复分解反应的两种物质在水溶液中相互交换离子,结合成沉淀、气体、水.
【拓展运用】除杂质题至少要满足两个条件:加入的试剂只能与杂质反应,不能与原物质反应.
解答 解:【练习质疑】③硫酸铜溶液和氢氧化钠溶液生成氢氧化铜沉淀和硫酸钠,反应的化学方程式为:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4.
④碳酸钠溶液和氯化钡溶液反应生成碳酸钡沉淀和氯化钠,反应的化学方程式为:Na2CO3+BaCl2═BaCO3↓+2NaCl.
【研究讨论】复分解反应实际参加反应的离子是能结合成沉淀、气体或水的离子,所以③中反应生成氢氧化铜沉淀,是氢氧根离子与铜离子;④中反应生成碳酸钡沉淀,是碳酸根离子与钡离子.
【构建网络】在这三种离子中NH4+与OH-能产生氨气和水,钡离子能与硫酸根离子产生白色沉淀,碳酸根离子与钙离子产生白色沉淀,故答案:NH4+;Ca2+;SO42-;
【拓展运用】(1)要除去硫酸钠溶液中的硫酸铵,实质就是除去铵根离子,可利用硫酸铵溶液与氢氧化钠反应生成硫酸钠、氨气和水的性质,能除去杂质且没有引入新的杂质,符合除杂原则.
(2)氯化钠溶液与硝酸钙溶液二者交换成分没有沉淀、气体或水生成,不能反应;
故答案为:【练习质疑】③2NaOH+CuSO4=Cu(OH)2↓+Na2SO4;④Na2CO3+BaCl2═BaCO3↓+2NaCl;
【研究讨论】OH-和Cu2+;CO32-和Ba2+;
【构建网络】NH4+;Ca2+;SO42-;
【拓展运用】NaOH.
点评 本题难度不大,掌握复分解反应的实质、化学方程式的书写、抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:初中化学 来源: 题型:解答题
| 试验次数 | 1 | 2 | 3 | 4 | 5 |
| 加入稀硫酸的质量/g | 20 | 20 | 20 | 20 | 20 |
| 充分反应后剩余固体的质量/g | 8 | 6 | 4 | 3 | m |
| 所得溶液的硫酸铜质量分数/% | P1 | P2 | P3 | P4 | P5 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 事实 | 解释 |
| A | 酒精温度计受热液柱上升 | 原子间间隔受热变大 |
| B | 碳酸钠溶液显碱性,稀硫酸显酸性 | 不同种物质的分子化学性质不同 |
| C | 氨水和氢氧化钠溶液都能使酚酞溶液变红 | 溶液中都含有相同的阴离子 |
| D | 金刚石和石墨的性质差异较大 | 碳原子的结构不同 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 该反应不可能是置换反应 | |
| B. | 该反应中不止一种元素的化合价发生变化 | |
| C. | 该反应中MnO2可能催化剂 | |
| D. | 该反应中MnOOH不是碱 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
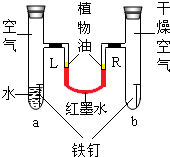 如图是探究铁锈蚀条件的装置.调节L端与R端的液面高度一致,塞紧木塞,一周后观察.下列推断错误的是( )
如图是探究铁锈蚀条件的装置.调节L端与R端的液面高度一致,塞紧木塞,一周后观察.下列推断错误的是( )| A. | b管中铁钉不容易锈蚀 | |
| B. | 铁锈蚀可能与空气、水有关 | |
| C. | L端与R端液面高度仍然保持一致 | |
| D. | a管中浸没在水中的那部分铁钉不容易锈蚀 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 物质 | 所含杂质 | 除去杂质的方法 |
| A | 铁粉 | 铜粉 | 加入过量稀盐酸,过滤 |
| B | 二氧化碳 | 一氧化碳 | 通入氧气点燃 |
| C | 硝酸铜溶液 | 硝酸银 | 加入过量铜粉,过滤 |
| D | 氢氧化钠溶液 | 碳酸钠 | 加入适量稀盐酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | m1=m2 | |
| B. | 25m1=21m2 | |
| C. | 混合物A中CaCO3和KHCO3质量比一定为1:1 | |
| D. | 混合物B中MgCO3和NaHCO3质量比可为任意比 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | a=b≥2.4g | B. | a=b≥1.8g | C. | a=2.4g,b=1.8g | D. | a<2.4g,b<1.8g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com