
【题目】为测定某BaCl2溶液的溶质质量分数,进行如下实验:取104g该溶液于烧杯中,加入1g稀硝酸溶液酸化,无任何现象,然后将30g一定溶质质量分数的硫酸溶液分三次加入,每次充分反应后过滤、称量(实验中物质的质量损失忽略不计),数据如表:
第1次 | 第2次 | 第3次 | |
加入硫酸溶液的质量/g | 10 | 10 | 10 |
过滤后溶液的质量/g | 105 | 105 | 111.7 |
根据以上数据计算:(BaCl2+H2SO4═BaSO4↓+2HCl)
(1)该实验过程中产生沉淀的总质量为 g。
(2)该BaCl2溶液中溶质的质量分数(写出计算过程)。
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:初中化学 来源: 题型:
【题目】下列化学反应中属于分解反应的是( )
A.NH3+H2O+CO2=NH4HCO3
B.2A1+3H2SO4=A12(SO4)3+3H2↑
C.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
D.CuSO4+Ca(OH)2=CaSO4+Cu(OH)2↓
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在对蜡烛及其燃烧进行了探究以后,请你填写下列空格:
(1)取一枝蜡烛,用小刀切下一小块,把它放入水中,蜡烛会________________。
结论:石蜡的密度比水_________________ 。
(2)点燃蜡烛,观察到蜡烛火焰分为三层,分别是________、________、________。

把一根火柴梗放在蜡烛火焰上约1S后取出,可以看到________处(填字母)的火柴梗最先碳化。
结论:蜡烛火焰的__________________温度最高。
(3)再将一只干燥的烧杯罩在蜡烛火焰的上方,烧杯内壁出现_____________,片刻后取下烧杯,迅速向烧杯内倒入少量的澄清石灰水,振荡后发现___________________。
结论;蜡烛燃烧以后的生成物是________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下表是Ca(OH)2和NaOH的溶解度数据.请回答下列问题:
![]()
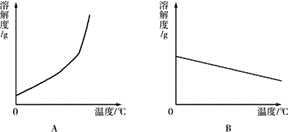
(1)依据上表数据,绘制Ca(OH)2和NaOH的溶解度曲线,下图中能表示NaOH溶解度曲线的是 (填A或B).
(2)要想把一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,具体措施有:
①加入氢氧化钙,②升高温度③降低温度,④加入水,⑤蒸发水后再恢复到原温度,⑥加入生石灰.
其中措施正确的是( )
A.②④⑥ B.③④ C.①③⑤⑥ D.①②⑤⑥
(3)20℃时,191 g饱和NaOH溶液,蒸发10 g水后,再降温到20℃,可析出NaOH晶体的质量为 .
(4)现有20℃时Ca(OH)2的饱和溶液(甲溶液),向其中加入一定量CaO后得到的溶液(乙溶液),此时溶液中溶质的质量分数乙 甲(填“>”、“<”或“=”).
(5)现有60℃时含Ca(OH)2和NaOH两种溶质的饱和溶液,若要得到较纯净的NaOH晶体,应采取的物理方法是 .
(6)20℃时,欲测定NaOH溶液的pH,若先将pH试纸用蒸馏水润湿,再进行测定,则所测溶液的pH (填“偏大”、“偏小”或“不受影响”).
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】走进“化学村”。 “化学村”的布局如下:

(1)认识“居民”。①10户“居民”中,俗称熟石灰的是____,属于氧化物的有_____ 。②盐酸有5户相邻的“居民”:Fe2O3、CO、Na2CO3、NaOH、CaCO3,其中不能与它发生反应的是_____。
(2)认识“村中的路”。只有相邻且能相互反应的“居民”间才是通路。例如,上图中涂成黑色实线的是一条从“Fe2O3家”到达出入口的路。请你在图中涂出一条从“CO2家”到达任一出入口的路______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是实验室制取气体的一些装置,据图回答问题。(以下所选装置均填装置序号)

(1)写出指定仪器的名称①______________;②_________________。
(2)如果用过氧化氢溶液同二氧化锰混合制氧气,要得到平稳的氧气流,应选用的气体发生装置是_______;反应的化学方程式为_______ ;
(3)B装置中试管口略向下倾斜的原因是_________,如果用该装置来加热高锰酸钾制氧气,需要改进的地方是_______;
(4)能用E装置收集的气体,必须具备的性质是________________________________;
(5)若装置C中反应剧烈,从实验安全角度考虑,可采取的措施有_____________(填序号)。
①用容积较小的锥形瓶 ②控制液体的滴加速度
③加热反应物 ④降低反应物浓度
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某学生加热氯酸钾制氧气时,错将高锰酸钾当成二氧化锰混入氯酸钾中,实验后果是( )
A. 反应速率加快,生成氧气的质量不变 B. 反应速率不变
C. 生成的氧气的质量不变 D. 反应速率加快,生成氧气的质量增加
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】硅是一种重要的半导体材料,应用范围广。三氯硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程如图所示:

(1)写出上述流程中一种氧化物的化学式:______________;
(2)上述流程中最后一步反应的化学方程式为____________________________,该反应属于________(填基本反应类型)反应;
(3)如果还原SiHCl3过程中混入O2,可能引起的后果是________;
(4)该流程中可以循环利用的物质的化学式是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com