
| A. | 若混合物为Mg、Fe,a可能是0.2g | |
| B. | 若混合物为Mg、Zn,a的值一定小于0.2g | |
| C. | 若混合物为Mg、Cu,a是0.1g,则该混合物中镁的质量分数为50% | |
| D. | 若混合物为Mg、Al,则加入的稀盐酸中溶质质量分数一定大于10% |
分析 因为金属与酸反应时生成氢气的质量=$\frac{金属的化合价}{金属的相对原子质量}$×金属的质量,所以同质量镁与酸反应生成氢气的质量均大于铁、锌,而小于铝.据此分析解答即可.
解答 解:假设合金中镁的质量为2.4 g,则根据化学反应的方程式:Mg+2HCl=MgCl2+H2↑可计算出此时产生氢气的质量为0.2 g,同理可计算出2.4 gAl与足量盐酸反应产生氢气的质量大于0.2 g,2.4gZn、2.4gFe与足量盐酸反应产生氢气的质量小于0.2 g,
A、若混合物为Mg、Fe,a一定小于0.2g,故A错误;
B、若混合物为Mg、Zn,a一定小于0.2g,故B正确;
C、若混合物为Mg、Cu,混合物中镁的质量分数为50%,则a一定时0.1g,故C正确;
D、当粉末为Mg、Al合金时,因相同质量的铝消耗稀盐酸的质量比镁消耗盐酸的质量大,而2.4gMg时,消耗盐酸的质量为7.3 g,所以合金为为Mg-Al合金时,所需盐酸溶质质量分数一定大于7.3%,故D错误.
故选:BC.
点评 相同质量的金属与酸反应产生氢气的质量的多少与金属的相对原子质量有关.若相对原子质量越大,产生的氢气质量越小.


科目:初中化学 来源: 题型:选择题
| A. | CaCl2→Ca(OH)2 | B. | CO2→Na2CO3 | C. | Cu(OH)2→CuSO4 | D. | Fe2O3→FeCl3 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用大量亚硝酸钠(Na2NO2)腌渍食品 | |
| B. | 用冷却结晶的方法从海水中提取粗盐 | |
| C. | 用含有氢氧化铝的药物治疗胃酸过多的病人 | |
| D. | 被黄蜂刺了(刺液呈碱性),涂上稀硫酸以减轻痛痒 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
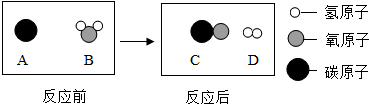
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 水 | B. | 稀盐酸 | C. | NaOH溶液 | D. | NH4Cl溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com