
| A. | +2 | B. | +4 | C. | -2 | D. | -4 |
科目:初中化学 来源: 题型:选择题
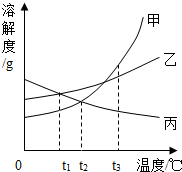 甲、乙、丙三种固体物质的溶解度曲线如图所示.下列叙述错误的是( )
甲、乙、丙三种固体物质的溶解度曲线如图所示.下列叙述错误的是( )| A. | t1℃时,将等质量的甲、乙分别配成饱和溶液,所得溶液质量:甲>乙 | |
| B. | 将t1℃时甲、丙的饱和溶液升温到t2℃,两种溶液中溶质的质量分数相等 | |
| C. | 将t2℃时甲的饱和溶液变为t3℃时甲的饱和溶液,可以采用蒸发水的方法 | |
| D. | 将t3℃时三种物质的饱和溶液恒温蒸发等量水后,析出溶质的质量:甲>乙>丙 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 原子 | B. | 元素 | C. | 分子 | D. | 单质 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
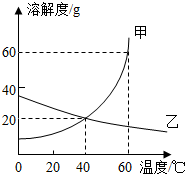 如图为甲、乙两种固体物质在水中的溶解度曲线,据此回答下列问题:
如图为甲、乙两种固体物质在水中的溶解度曲线,据此回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
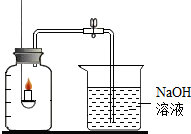 某兴趣小组用如图所示装置进行空气含氧量及助燃实验.实验前已检查好装置气密性,并使导管充满水,先关闭止水夹,再进行实验(以下三个实验均重复此操作).
某兴趣小组用如图所示装置进行空气含氧量及助燃实验.实验前已检查好装置气密性,并使导管充满水,先关闭止水夹,再进行实验(以下三个实验均重复此操作).查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 硫在氧气中燃烧生成一种无色无味气体 | |
| B. | 电解水时负极产生的气体能使带火星的木条复燃 | |
| C. | 点燃可燃性气体前要检验气体的纯度 | |
| D. | 稀释浓硫酸时,把浓硫酸沿器壁慢慢地注入盛有水的量筒内 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 实验结论 | |
| 乙同学 实验 | 取中和反应后的溶液少许于试管中,将表面反复打磨后的铝片放入试管的溶液中 | 铝片逐渐溶解,并有大量气泡冒出,收集气体点燃,火焰呈淡蓝色 | 猜想(2)成立 |
| 丙同学 实验 | 取中和反应后的溶液少许于试管中,向试管中滴加几滴无色酚酞试液 | 溶液变红色 | 猜想(3)成立 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com