
【题目】下图是元素周期表中1-18号元素的原子结构示意图,请回答下列问题:
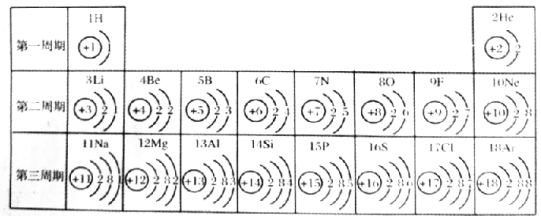
(l)原子序数为17的元素属于______(填“金属”或“非金属”)元素。表中与该元素化学性质相似的元素是_______(填元素名称)。
(2)X3-和氖原子的核外电子排布相同,则X的元素符号是______。
(3)同一周期,从左到右,各元素原子的______依次递增。
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组通过探究活动学习和理解化学知识.请你一起研究学习,并回答有关问题.
研究主题:水溶液中复分解反应的实质
相关信息:一定体积的溶液中,离子的数目越多,其离子的浓度越大.电导率传感器用于测量溶液的导电性强弱,能反映离子浓度大小.相同温度下同种溶液电导率越大,离子浓度越大.
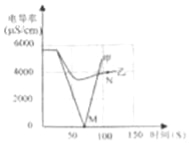
(1)实验一:恒温条件下,向一定体积一定浓度的稀Ba(OH)2溶液中滴加2﹣3滴无色酚酞试液,插入电导率传感器,然后滴加稀硫酸,测得溶液的电导率变化如图中甲曲线所示.
①写出Ba(OH)2与H2SO4反应的化学方程式 .
②甲曲线M点时混合液体呈 色;
③通过对甲曲线的分析,下列说法错误的是 (填序号).
A.M点前曲线下滑的过程中,H+和OH﹣结合成H2O,Ba2+和SO42﹣结合成BaSO4
B.M点时离子浓度几乎为零 C.M点后溶液电导率逐渐增大,仅由于溶液中H+在逐渐增大
(2)实验二:恒温条件下,向等量同浓度的稀Ba(OH)2溶液中滴加2﹣3滴无色酚酞试液,插入电导率传感器,然后滴加稀Na2SO4溶液,测得溶液的电导率变化如上图乙曲线所示.
①通过对乙曲线的分析,下列说法错误的是 (填序号).
A.开始至完全反应过程中,电导率减小,溶液由红色逐渐变为无色
B.电导率下降到最低点时仍然较大,表明溶液中还存在较多离子
C.整个实验过程中,溶液中Na+数目一直增大
②N点时,溶液中含有的离子是 (填离子符号).
③通过比较分析,结合已学知识可知,溶液中复分解反应的实质是参与反应的离子,结合生成了沉淀、气体或水,导致其浓度 (填“增大”或“减小”).
(3)拓展:①请根据示例仿写离子方程式.
示例AgNO3+NaCl=AgCl↓+NaNO3离子方程式:Ag++Cl﹣=AgCl↓
仿写:BaCl2+Na2SO4=BaSO4↓+2NaCl离子方程式: .
②向一定量饱和澄清石灰水中持续通入过量的CO2气体,溶液先变浑浊后浑浊逐渐消失.请推测此过程的溶液中Ca2+的浓度变化情况 .
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】按下列方法配制的溶液,其溶质质量分数为5%的是
A.称取5.0g氯化钾,溶解在95mL水中,充分搅拌
B.称取5.0g生石灰,放入95mL水中,充分搅拌
C.量取5.OmL浓盐酸,倒入95mL水中,充分搅拌
D.称取5.0g二氧化锰,放入95mL水中,充分搅拌
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】AgNO3固体见光或受热易分解,故保存在棕色瓶中,AgNO3 见光分解时产生一种有刺激性气味的气体,该气体可能是
A. H2S B. SO2 C. N2 D. NO2
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】对分子和原子两种微粒的叙述正确的是
A.原子构成分子,物质只能由分子构成 B.同种原子可能构成不同的分子
C.化学变化中分子数目一定发生变化 D.分子质量一定大于原子质量
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据以下装置图,回答有关问题:
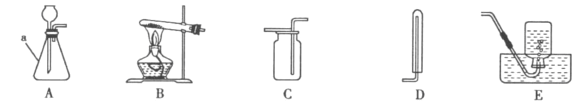
(l)写出图中标号为a的仪器名称_______。
(2)实验室用氯酸钾制取氧气,化学方程式为_______,该反应的基本反应类型是_______,停止加热时应先将导管移出水面,其理由是_______。
(3)用C装置收集氧气,验满的方法是_______。
(4)实验室制取CO2应选择的发生和收集装置是_______(填字母序号)。
(5)用A装置制气体时,长颈漏斗的下端管口要_______,以防止生成的气体逸出。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用适当的化学用语填空
(1)2个氮气分子______ (2)+5价的磷形成的氧化物_______
(3)硝酸中的阴离子_________ (4)常用于改良酸性土壤的碱_________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com