
下列设计方案是利用物质的化学性质达到实验目的的是
A.观察小木条燃烧情况,比较“人吸入空气和呼出气体”中氧气含量的大小
B.利用黄铜片和铜片相互刻划,比较它们的硬度
C.利用活性炭的吸附作用可以把冰箱中的异味除去
D.在实验室里通常用蒸馏的方法把硬水软化
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案科目:初中化学 来源: 题型:
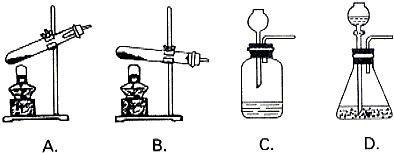

查看答案和解析>>
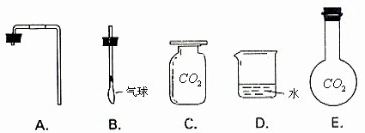
科目:初中化学 来源: 题型:
| 组别 | 温度 | 二氧化锰的质量 | 双氧水的浓度和体积 | 观察产生气泡的速率 |
| 1 | 室温 | 0.5g | 5%、50mL | 反应平稳,有大量气泡产生 |
| 2 | 加热 | 0.5g | 5%、50mL | 气泡急速产生,并产生大量白雾 |
| 3 | 室温 | 0.5g | 30%、50mL | 气泡呈爆发式产生,并带出反应液 |
查看答案和解析>>
科目:初中化学 来源: 题型:

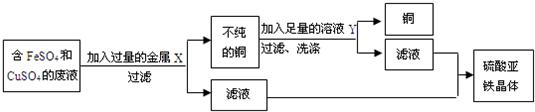
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 (2011?南岗区一模)张南同学为了验证Na2CO3溶液中的碳酸根离子,做了如下实验.操作如下:①向一支试管中加入约3mL的Na2CO3溶液,并滴入2滴酚酞试液,振荡试管,溶液呈均匀的红色;②再向此试管中逐滴加入稀盐酸,边滴加边振荡,至溶液颜色由红色恰好变为无色.
(2011?南岗区一模)张南同学为了验证Na2CO3溶液中的碳酸根离子,做了如下实验.操作如下:①向一支试管中加入约3mL的Na2CO3溶液,并滴入2滴酚酞试液,振荡试管,溶液呈均匀的红色;②再向此试管中逐滴加入稀盐酸,边滴加边振荡,至溶液颜色由红色恰好变为无色.| 编号 | 方案 | 实验步骤 | 现象 | 实验结论 |
| 猜想 ② |
利用CO2的溶解度受温度的升高而溶解度降低,给试管加热,用石灰水检验产生的气体. | 取其中的1支试管,在酒精灯上加热,再将产生的气体通入石灰水中 | 石灰水没有变白色浑浊 | 猜想② 不成立 |
| 猜想 ③ |
加入盐酸的量不足,继续加盐酸. | 再取其中的另1支试管,再继续滴加稀盐酸. | 有气泡产生 有气泡产生 |
猜想③ 成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 物 质 | Ca(HCO3)2 | Mg(HCO3)2 | Ca(OH)2 | Mg(OH)2 | CaCO3 | MgCO3 |
| 溶解性 | 可溶 | 可溶 | 微溶 | 不溶 | 不溶 | 微溶 |
| 实验操作 | 实例现象 | 实验结论 |
| 水垢中无Ca(OH)2 |
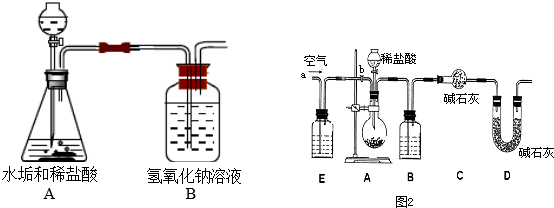
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com