
分析 由赤铁矿石的质量、氧化铁的质量分数、生铁中铁的质量分数,根据赤铁矿炼铁的化学方程式可以列式计算出炼出生铁的质量.
解答 解:设可炼出含杂质2%的生铁的质量为x,
Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2
160 112
1600t×(1-20%)(1-2%)x
$\frac{160}{112}=\frac{1600t×(1-20%)}{(1-2%)x}$ x≈914.3t.
答:可炼出含杂质2%的生铁914.3t.
点评 本题难度不大,考查含杂质物质的化学方程式的计算,注意代入方程式计算的必须是纯物质的质量是正确解答此类题的关键.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
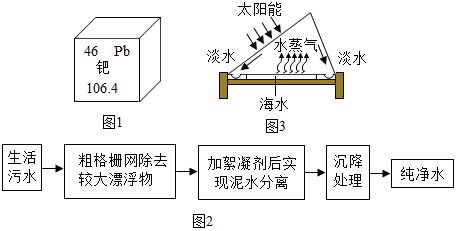
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 物质 | a | b | c | d |
| 反应前质量/g | 5.0 | 1.2 | 2.0 | 0.5 |
| 反应后质量/g | 待测 | 3.0 | 3.6 | 0.5 |
| A. | a是反应物,b、c是生成物 | B. | 该反应为分解反应 | ||
| C. | d可能是催化剂 | D. | 反应后a的质量为3.4g |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 白色粉末的成分 | 形成的原因 |
| 可能是CaCO3 | 石灰水与空气中CO2反应;化学方程式为Ca(OH)2+CO2=CaCO3↓+H2O |
| 可能是Ca(OH)2 | 暑假气温较高,溶质的溶解度降低或溶剂蒸发,石灰水中的溶质结晶析出 |
| OH- | Cl- | CO32- | NO3- | |
| Ca2+ | 微 | 溶 | 不 | 溶 |
| 实验步骤 | 可能观察到的现象 | 结论 |
| 取上述试管中的上层清液,滴加1~2无色酚酞试液 | 无色溶液变红 | 白色粉末含有Ca(OH)2 |
| 往上述试管中的残留的固体中加入稀盐酸 | 产生气泡 | 白色粉末中有CaCO3 |
| 由上述实验可知白色粉末的成分是:氢氧化钙、碳酸钙 | ||
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 如图是氧、镁、硫三种元素的原子结构示意图.由图可知,氧元素在化学反应中易得到电子(填“得到”或“失去”);镁元素和氧元素形成的化合物的化学式为MgO;化学性质相似的两种元素是氧和硫.
如图是氧、镁、硫三种元素的原子结构示意图.由图可知,氧元素在化学反应中易得到电子(填“得到”或“失去”);镁元素和氧元素形成的化合物的化学式为MgO;化学性质相似的两种元素是氧和硫.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com