
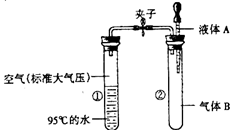
| A. | A为氯化钙溶液,B为二氧化碳气体 | |
| B. | A为氢氧化钠溶液,B为二氧化硫气体 | |
| C. | A为氢氧化钙溶液,B为一氧化碳气体 | |
| D. | A为稀硫酸溶液,B为二氧化碳气体 |
分析 水的沸点与压强有关,压强越小,水的沸点越低;压强越大,水的沸点越高.夹子开始处于关闭状态,将液体A滴入试管②中与气体B充分反应,打开夹子,从而使得①中的压强减小,水的沸点降低,水沸腾了;据此进行分析解答
解答 解:A、氯化钙溶液不与二氧化碳气体反应,打开夹子时①中的压强不变,水的沸点不变,故选项错误.
B、氢氧化钠溶液能吸收二氧化硫气体,打开夹子时①中的气体进入②中,从而使得①中的压强减小,水的沸点降低,水沸腾了,故选项正确.
C、氢氧化钙溶液不与一氧化碳气体反应,打开夹子时①中的压强不变,水的沸点不变,故选项错误.
D、稀硫酸溶液不与二氧化碳气体反应,打开夹子时①中的压强不变,水的沸点不变,故选项错误.
故选:B.
点评 本题难度不是很大,充分理解水沸腾的原因、熟练掌握碱的化学性质、常见气体的化学性质是正确解答本题的关键.


科目:初中化学 来源: 题型:选择题
| A. |  氧气的验满 | B. |  放置氧气 | C. |  熄灭酒精灯 | D. |  收集二氧化碳 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
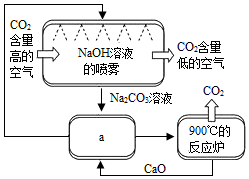 空气中CO2浓度的持续走高引起人们的高度重视.一些科学家认为,人类不仅要努力减少CO2的排放,还要尽快想办法清除空气中过多的CO2.为此,他们设想了一系列“捕捉”CO2的方法.一些科学家利用NaOH溶液的喷淋“捕捉”空气中的CO2,如图2所示.
空气中CO2浓度的持续走高引起人们的高度重视.一些科学家认为,人类不仅要努力减少CO2的排放,还要尽快想办法清除空气中过多的CO2.为此,他们设想了一系列“捕捉”CO2的方法.一些科学家利用NaOH溶液的喷淋“捕捉”空气中的CO2,如图2所示.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氯化铁溶液中滴加氢氧化钠溶液出现蓝色絮状沉淀 | |
| B. | 酚酞试液滴入食盐溶液中变蓝色 | |
| C. | 铁锈放入稀硫酸中溶液变蓝色 | |
| D. | 硫在氧气中燃烧发出明亮的蓝紫色火焰 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 产生的气体可能是H2 或O2 或SO2 | |
| B. | 产生的气体可能是CO2 | |
| C. | CuSO4溶液中可能含有少量的某种酸 | |
| D. | CuSO4溶液的pH可能小于7 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题

查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com