

 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:初中化学 来源: 题型:阅读理解
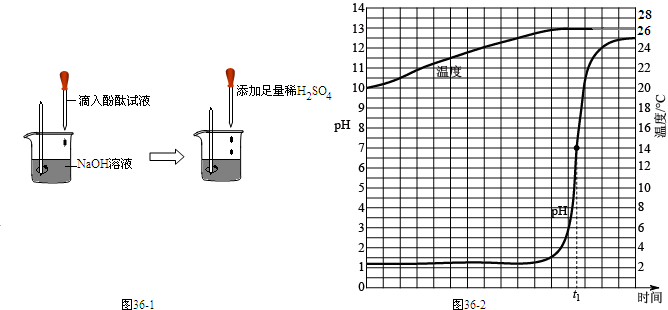
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
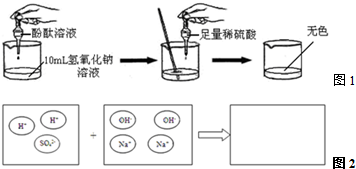
| 实验方案 | 实验步骤 | 实验现象 | 实验结论 |
| 方案一 | 取样,滴入适量的BaCl2溶液 | 出现白色沉淀 | 稀H2SO4过量 |
| 方案二 | 取样,滴入几滴紫色石蕊溶液 | 溶液变红 | 稀H2SO4过量 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实验步骤 | 实验现象 | 结论 |
| a.向烧杯中加入10ml 氢氧化钠溶液,并滴入几滴酚酞溶液; b.再用滴管慢慢滴入稀硫酸,并不断搅拌 |
a.溶液颜色 变红色 变红色 ;b.不断搅拌溶液至溶液 颜色恰好变成 无色 无色 为止. |
酸和碱发生了中和反应, 该反应属四种基本反应 类型中的 复分解反应 复分解反应 反应. |
| 实验方案 | 实验步骤 | 实验现象 | 实验结论 |
| 方案一 | 取样,滴入适量的氯化钡溶液 | 出现白色沉淀 | 硫酸过量 |
| 方案二 | 取样,滴入几滴无色酚酞溶液 | 酚酞溶液不变色 | 酸、碱恰好反应 |
| 方案三 | 取样,滴入几滴紫色石蕊溶液 | 溶液变红 | 硫酸过量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com