取可燃物12.4克充分燃烧,测得生成二氧化碳17.6克和水10.8克.试计算:
(1)该可燃物含有的元素各多少克?
(2)若可燃物的相对分子质量为62,试通过计算写出化学式.
【答案】
分析:在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子的质量也没有改变,所以反应前后物质的质量总和相等.
所以可以比较反应后生成物中C、H元素质量和与可燃物质量,确定可燃物中是否含有O元素.
然后根据C、H、O的质量求出原子的个数比,结合相对分子质量求出化学式.
解答:解:(1)17.6g CO
2中C元素质量=17.6g×
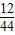
×100%=4.8g
10.8gH
2O中H元素质量=10.8g×
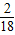
×100%=1.2g
可燃物质中C、H元素的质量和=4.8g+1.2g=6.0g<12.4g
所以可燃物中一定含有O元素,其质量为12.4g-6g=6.4g
答:可燃物中碳元素的质量为4.8g,氢元素的质量为1.2g,氧元素的质量为6.4g
(2)可燃物中C、H、O的原子个数之比为
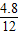
:
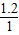
:

=1:3:1
设可燃物的化学式为C
xH
3xO
x,根据题意知其相对分子质量为62,
可得:12x+3x+16x=62
解之得:x=2
所以化学式为:C
2H
6O
2点评:化学反应的过程,就是参加反应的各物质(反应物)的原子,重新组合而生成其它物质的过程.可燃物中的C、H元素燃烧分别生成CO
2和H
2O.

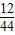 ×100%=4.8g
×100%=4.8g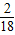 ×100%=1.2g
×100%=1.2g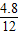 :
: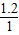 :
: =1:3:1
=1:3:1

 智能训练练测考系列答案
智能训练练测考系列答案