
| A. | 镁带在空气中燃烧后,生成物的质量跟原镁带的质量相等 | |
| B. | 在反应3Cu+8HNO3═3Cu(N03)2+2X↑+4H20中的X的化学式是NO2 | |
| C. | 加热24.5gKClO3和4gMnO2的混合物,反应一段时间后,剩余固体24.9g,则O2的质量为3.6g | |
| D. | 某纯净物在氧气中燃烧后生成CO2、SO2和CO,该物质中一定含有C、S、O元素 |
分析 化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和.
解答 解:A、镁带在空气中燃烧后,生成物的质量等于反应的镁的质量和反应的氧气质量之和,该选项说法不正确;
B、根据质量守恒定律,反应前后原子种类和个数都不变,由方程式知反应物中含有的原子种类及原子个数为Cu,3;H,8;N,8;O,24;已知生成物中含有的原子种类及原子个数为Cu,3;H,8;N,2;O,22;比较分析可知X中含有N和O元素,其原子个数分别为2和2,故X的化学式为NO.该选项说法不正确;
C、根据质量守恒定律,生成氧气的质量为:24.5g+8g-27.7g=4.8g;该选项说法正确;
D、由题意“某纯净物在氧气中燃烧后生成CO2、SO2、和CO,”,故:则生成物中含有的元素种类为:硫元素、碳元素、氢元素,根据质量守恒定律的元素守恒,知道了元素的种类不变,则可推测该物质的组成中一定含有的元素为硫、碳元素,可能含有O.该选项说法不正确.
答案:C.
点评 化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、进行相关方面计算的基础.


科目:初中化学 来源: 题型:解答题
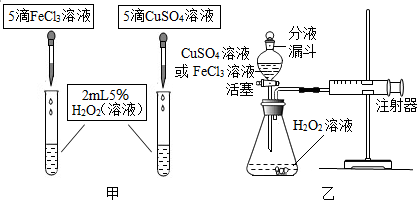
| 实验操作 | 实验现象 | 实验结论 |
| 分别取同温度同体积同浓度的H2O2溶液于2支试管中,再分别加入等质量的FeCl3和NaCl.观察现象. | 加入FeCl3的试管中产生的气体快,加入NaCl的试管中产生的气体慢. | 证明是Fe3+影响过氧化氢的分解速率 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
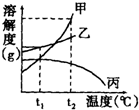
| A. | 将甲乙、丙、的饱和溶液分别从t1℃升高到t2℃,只有丙有晶体析出 | |
| B. | t2℃时,配制相同质量甲、乙、丙三种物质的溶液时,所需溶质的质量是甲>乙>丙 | |
| C. | 升高温度可以提高甲物质的溶解度 | |
| D. | 使乙从其饱和溶液中析出,可采用冷却热饱和溶液的方法 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②③④ | C. | ①②③ | D. | ①③④ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
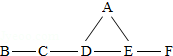 A、B、C、D、E、F分别是氧化铁、稀盐酸、氢氧化钙溶液、碳酸钠溶液、氢氧化钠溶液、二氧化碳中的一种,B不属于氧化物.他们之间有如图所示的反应关系,图中短线相连的物质间能发生反应.请回答
A、B、C、D、E、F分别是氧化铁、稀盐酸、氢氧化钙溶液、碳酸钠溶液、氢氧化钠溶液、二氧化碳中的一种,B不属于氧化物.他们之间有如图所示的反应关系,图中短线相连的物质间能发生反应.请回答查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 硬质玻璃管中空气的体积 | 反应前注射器中空气体积 | 反应后注射器中气体体积 | 实验测得空气中氧气的体积分数 |
| 25mL | 15mL | 9mL | 15% |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com