
| 温度/℃ | 10 | 20 | 30 | 40 | |
| 溶解度/g | 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 |
| 碳酸钠 | 12.2 | 21.8 | 39.7 | 53.2 | |

分析 (1)①由氯化钠和碳酸钠在不同温度时的溶解度表,查出40℃时氯化钠的溶解度即可;
②由碳酸钠在不同温度时的溶解度表,确定碳酸钠的溶解度受温度影响的变化趋势即可;
20℃时,碳酸钠的溶解度为21.8g,进行分析解答;
③根据饱和溶液中溶质质量分数=$\frac{溶解度}{溶解度+100g}$×100%,进行分析解答;
(2)根据铁的金属活动性比氢强,铜的金属活动性比氢弱,铁能与稀盐酸反应生成氯化亚铁溶液和氢气,铜不与稀盐酸反应,进行分析解答.
解答 解:(1)①40℃时,氯化钠的溶解度为36.6g;
②由碳酸钠在不同温度时的溶解度表,碳酸钠的溶解度随温度的升高而增大.
20℃时,碳酸钠的溶解度为21.8g,在20℃时,将30g碳酸钠加入到100g水中,充分搅拌后,最多只能溶解21.8g,得到的是饱和溶液;
③饱和溶液中溶质质量分数=$\frac{30g}{30g+100g}$×100%=23.1%,10℃时,氯化钠和碳酸钠的溶解度分别是35.8g、12.2g,分别配制表中两种物质的饱和溶液,其中溶质质量分数较小的物质是碳酸钠;
(2)铁的金属活动性比氢强,铜的金属活动性比氢弱,将足量的稀盐酸加入一定量的铁、铜混合物中,铁能与稀盐酸反应生成氯化亚铁溶液和氢气,铜不与稀盐酸反应,反应的化学方程式为:Fe+2HCl═FeCl2+H2↑;
铁与稀盐酸接触就产生氢气,随着反应的进行,氢气的质量增加,当铁完全反应后,氢气的质量不再改变;随着反应的进行,铁参加反应,金属混合物的质量不断减小,当铁完全反应后,剩余固体是铜,质量不再减小;观察图象,所以AC表示正确.
故答案为:(1)①36.6;
②增大,饱和溶液,23.1%;
③碳酸钠饱和溶液;
(2)Fe+2HCl=FeCl2+H2↑,AC.
点评 本题难度不大,掌握溶解度受温度影响的变化趋势、溶解度的含义、饱和溶液中溶质质量分数=$\frac{溶解度}{溶解度+100g}$×100%、金属的化学性质、化学方程式的书写方法等是正确解答本题的关键.


科目:初中化学 来源: 题型:选择题
| A. | 可用于钻探 | B. | 属于有机合成材料 | ||
| C. | 可用于机械加工 | D. | 可用于刻划玻璃 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
 A、B、C 三种物质的转化关系如图所示:
A、B、C 三种物质的转化关系如图所示:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 温度 | NH4Cl | NH4HCO3 | NaHCO3 | NaCl |
| 30℃ | 41.1g | 27.0g | 11.1g | 36.3g |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 物质与熟石灰混合研磨,可以证明其能否作氮肥 | |
| B. | 向锁孔中刮入少量铅笔芯粉末,能使锁开启更灵活 | |
| C. | 滴加稀盐酸可检验生石灰样品中是否含有熟石灰 | |
| D. | 测定水样的pH,能区分硬水和软水 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
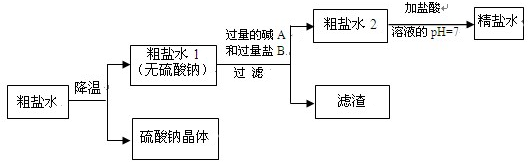
 某制备氢气新工艺的主要流程如下:
某制备氢气新工艺的主要流程如下:查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 实验室中有一瓶标签受损的无色液体,如图所示.这瓶无色液体是什么呢?实验员老师告诉大家,该液体只能是过氧化氢溶液、稀硫酸.
实验室中有一瓶标签受损的无色液体,如图所示.这瓶无色液体是什么呢?实验员老师告诉大家,该液体只能是过氧化氢溶液、稀硫酸.| 实验操作 | 实验现象 | 实验结论 |
| 步骤一:取该液体适量于试管中,向其中加入少 量二氧化锰粉末. | 没有气泡产生. | 该液体不是过氧化氢溶液. |
| 步骤二:取该液体适量于试管中,向其中滴加少量硝酸钡溶液. | 有白色沉淀生成 | 该液体是稀硫酸. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com