
| A. | 降低可燃物的着火点 | B. | 增大与空气的接触面积 | ||
| C. | 提高可燃物的着火点 | D. | 增加空气中氧气含量 |
分析 燃烧需要同时满足三个条件:①可燃物、②氧气或空气、③温度要达到着火点;促进可燃物燃烧的方法有:增大可燃物与氧气的接触面积或增大氧气的浓度,据此进行分析判断.
解答 解:A、酒精灯的火焰太小时,将灯芯拔得松散些,可使火焰更旺,是利用了增大可燃物与空气的接触面积的原理;可燃物的着火点一般是不变的,不能降低可燃物的着火点,故选项错误.
B、酒精灯的火焰太小时,将灯芯拔得松散些,可使火焰更旺,是利用了增大可燃物与空气的接触面积的原理,故选项正确.
C、酒精灯的火焰太小时,将灯芯拔得松散些,可使火焰更旺,是利用了增大可燃物与空气的接触面积的原理;可燃物的着火点一般是不变的,不能提高可燃物的着火点,故选项错误.
D、酒精灯的火焰太小时,将灯芯拔得松散些,可使火焰更旺,是利用了增大可燃物与空气的接触面积的原理,而不是加空气中氧气的含量,故选项错误.
故选:B.
点评 本题难度不大,掌握促进可燃物燃烧的方法(增大可燃物与氧气的接触面积或增大氧气的浓度)是正确解答本题的关键.


科目:初中化学 来源: 题型:解答题
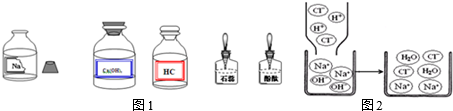
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
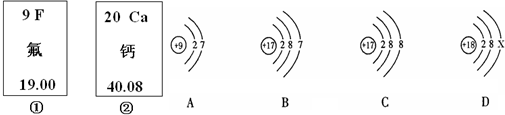
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 实验结论 |
| (1)取少量固体于试管中,加适量水振荡后静置,再滴几滴无色酚酞试液 | 溶液变红 | 说明固体成分中一定含有 氧化钙 |
| (2)再取少量固体于另一试管中滴加过量稀盐酸 | 有气泡生成 | 说明固体成分中一定含有 碳酸钙 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
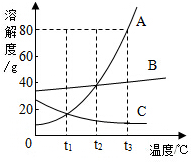 如图是A、B、C三种物质的溶解度曲线,回答下列问题:
如图是A、B、C三种物质的溶解度曲线,回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 实验结论 |
| 取一定量纯碱样品配成溶液后,滴加过量的CaCl2溶液. | 产生白色沉淀 | 反应的化学方程式: Na2CO3+CaCl2=CaCO3+2NaCl |
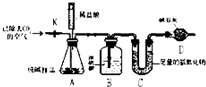
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
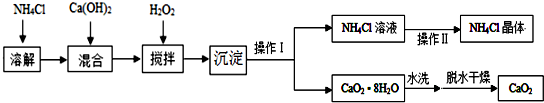
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com