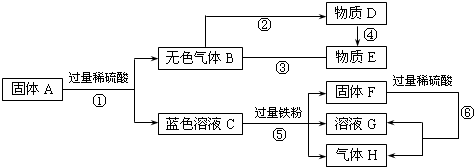
【答案】
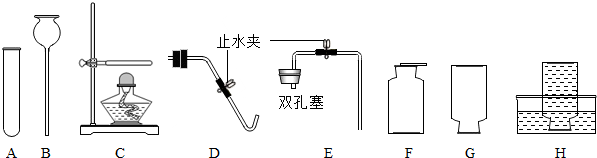
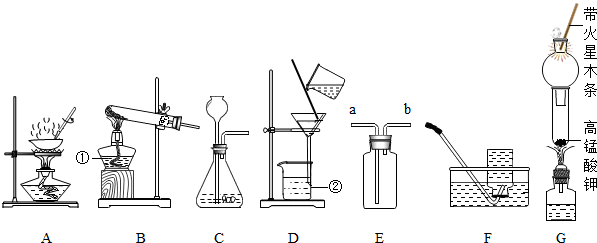
分析:(1)用高锰酸钾制取氧气,需要加热,属于固体加热型,故选发生装置B,氧气的密度比空气大且不易溶于水,故可用向上排空气法或排水法收集,并据高锰酸钾分解的反应原理书写方程式;
(2)用过氧化氢溶液与二氧化锰固体混合制取氧气属于固液常温型,分液漏斗可控制液体的滴加速度,过氧化氢在二氧化锰的催化作用下分解生成水和氧气,据此分析解答;
(3)根据实验室制取二氧化碳的药品、反应原理,二氧化碳的性质分析解答;
(4)根据装置选取方法分析解答;
(5)根据装置中发生的化学反应书写方程式;
(6)停止加热,应该先撤去导管后熄灭酒精灯,灼热的铜容易被氧气氧化,所以要做好密闭措施.
解答:解:(1)用高锰酸钾制取氧气,需要加热,属于固体加热型,故选发生装置B,氧气的密度比空气大且不易溶于水,故可用向上排空气法或排水法收集,高锰酸钾分解生成锰酸钾、二氧化锰和氧气,反应方程式是:2KMnO
4
K
2MnO
4+MnO
2+O
2↑;
(2)用过氧化氢溶液与二氧化锰固体混合制取氧气属于固液常温型,分液漏斗可控制液体的滴加速度,进而控制反应速率,故发生装置选择A;过氧化氢在二氧化锰的催化作用下分解生成水和氧气,方程式是:2H
2O
2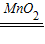
2H
2O+O
2↑;
(3)实验室制取二氧化碳的药品是大理石或石灰石和稀盐酸反应制取,属于固液常温型,故可用A或C制取;二氧化碳的密度比空气大且能溶于水,故只能用向上排空气法收集;大理石的主要成分碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,方程式是:CaCO
3+2HC1=CaCl
2+H
2O+CO
2↑;
(4)用氢氧化钙与氯化铵的固体混合物加热制取氨气,属于固体加热型,故选发生装置B;氨气极易溶于水,密度比空气小,故可用向下排空气法收集;
(5)试管①中发生的反应是碳和氧化铜高温生成铜和二氧化碳,方程式是:C+2CuO
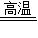
2Cu+CO
2↑;②中石灰水的主要成分氢氧化钙和二氧化碳反应生成碳酸钙沉淀和水,方程式是CO
2+Ca(OH)
2═CaCO
3↓+H
2O;
(6)停止加热,应该先撤去导管后熄灭酒精灯,防止水倒吸入热的试管引起试管炸裂,用弹簧夹夹紧橡皮管,待试管①冷却后再把试管里的粉末倒出,是为了防止灼热的铜容易被氧气氧化成氧化铜;
故答案为:(1)B;D或F;2KMnO
4
K
2MnO
4+MnO
2+O
2↑;
(2)A;2H
2O
2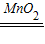
2H
2O+O
2↑;
(3)大理石或石灰石;稀盐酸;A或C;D;CaCO
3+2HC1=CaCl
2+H
2O+CO
2↑;
(4)B;E;
(5)C+2CuO

2Cu+CO
2↑;CO
2+Ca(OH)
2═CaCO
3↓+H
2O;
(6)防止水倒吸和防止灼热的铜被氧化.
点评:本题主要考查了实验室制取气体的装置选取方法、注意事项、方程式的书写等知识,发生装置依据反应物的状态和反应条件进行选择,收集装置依据气体的密度和溶解性进行选择.

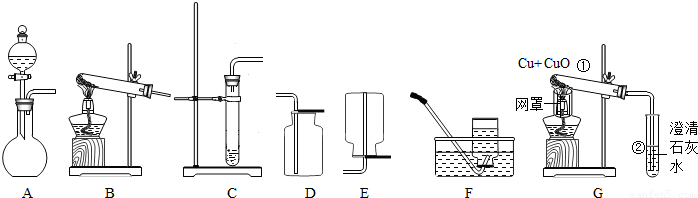
 K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑;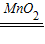 2H2O+O2↑;
2H2O+O2↑;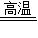 2Cu+CO2↑;②中石灰水的主要成分氢氧化钙和二氧化碳反应生成碳酸钙沉淀和水,方程式是CO2+Ca(OH)2═CaCO3↓+H2O;
2Cu+CO2↑;②中石灰水的主要成分氢氧化钙和二氧化碳反应生成碳酸钙沉淀和水,方程式是CO2+Ca(OH)2═CaCO3↓+H2O; K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑;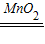 2H2O+O2↑;
2H2O+O2↑; 2Cu+CO2↑;CO2+Ca(OH)2═CaCO3↓+H2O;
2Cu+CO2↑;CO2+Ca(OH)2═CaCO3↓+H2O;

 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案