
|
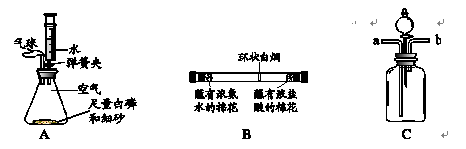
|
|
 2P2O5
2P2O5 2P2O5,燃烧后消耗氧气,使锥形瓶内气压减小,小于外部大气压,注射器中的水被吸入锥形瓶内。消耗氧气体积为220mL×1/5="44" mL, 注射器中的水还剩50 mL - 44mL="6" mL
2P2O5,燃烧后消耗氧气,使锥形瓶内气压减小,小于外部大气压,注射器中的水被吸入锥形瓶内。消耗氧气体积为220mL×1/5="44" mL, 注射器中的水还剩50 mL - 44mL="6" mL

 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 将一根未打磨的铝条放入硫酸铜溶液中 | 无紫红色固体析出 | 铝不如铜活泼 |
| B | 将带火星的木条伸入氧气中 | 木条复燃 | 氧气能支持燃烧 |
| C | 将CO通入灼热的氧化铜 | 黑色氧化铜变成红色 | CO具有可燃性 |
| D | 将二氧化碳通入紫色石蕊试液中 | 紫色石蕊试液变成红色 | CO2具有酸性 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.水通电分解时生成氢气和氧气,说明水是由氢气和氧气组成 |
| B.通过在显微镜下观察木炭,得知木炭具有疏松多孔的结构 |
| C.天然气能在氧气中燃烧,说明氧气具有可燃性 |
| D.将石蕊试液滴入稀硫酸中溶液显红色,说明石蕊试液能使酸变红 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| 操作步骤 | 现象 | 结论 |
| 取呼出气体和等体积的空气各一瓶,将燃着的小木条分别插入集气瓶中,盖上玻璃片 | | 人体呼出气体中氧气的含量小于空气中氧气的含量 |
| 取呼出气体和等体积的空气各一瓶,向其中各滴入相同滴数的澄清石灰水 | 呼出气体瓶中澄清石灰水变浑浊,空气瓶中无明显现象 | |
| | 被哈气的干燥玻璃片上有水珠,未被哈气的干燥玻璃片上没有明显现象 | 人体呼出气体中水蒸气的含量高于空气中水蒸气的含量 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| 实验步骤 | 实验现象 | 实验结论 |
| (1)取样于试管中,滴加稀盐酸 | 有 生成 | 原溶液里一定有碳酸钙 |
| (2)另取样于试管中,滴加酚酞试液 | 溶液成红色 | 原溶液一定有 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
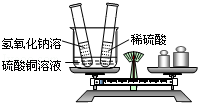
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| 实 验 步 骤 | 可能出现的实验现象 | 实验结论 |
| (1)取少量滤液于试管中,加入碳酸钠溶液 | 产生 | 假设③成立 |
| (2)取少量滤液于试管中,加入足量稀盐酸 | 放出无色气体 | 假设 成立 |
| (3)取少量滤液于试管中,加入碳酸钠溶液或足量稀盐酸 | 没有明显现象 | 假设 成立 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| 序号 | KClO3的质量 | 其他物质的质量 | 温度 | 氧气的体积 | 反应所需时间 |
| ① | 2.0g | | 330℃ | 100mL | T1 |
| ② | 2.0g | CuO 0.5g | 330℃ | 100mL | T2 |
| ③ | 2.0g | MnO2 0.5g | 330℃ | 100mL | T3 |
| ④ | 2.0g | MnO2 g | 380℃ | 100mL | T4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com