
| 20℃ | 8%Na2CO3溶液 | 8%NaHCO3溶液 |
| pH | 10.6 | 8.0 |
| 溶解度 | 10℃ | 20℃ | 30℃ | 40℃ |
| Na2CO3 | 12.5g | 21.5g | 39.7g | 49.0g |
| NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
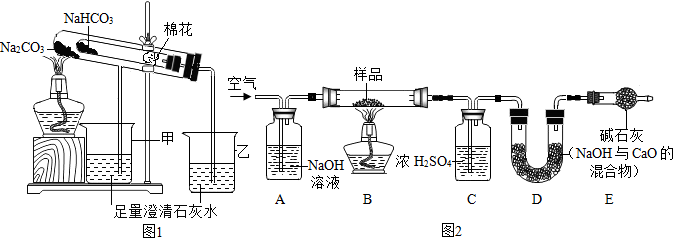
分析 【探究一】
(1)根据溶液pH值分析酸碱性解答;据测定溶液酸碱度的方法以及溶液的酸碱度与酸碱性的关系来分析;
(2)根据碳酸氢钠加热分解为碳酸钠、水和二氧化碳,二氧化碳能和澄清的石灰水变浑浊来分析;
(3)根据20℃时碳酸钠和碳酸氢钠的溶解度来分析;
【探究二】
(4)根据实验前先通一段时间的空气的目的是排尽装置内的空气(或二氧化碳)解答;
(5)根据空气经过装置A时,其中的二氧化碳与氢氧化钠反应生成碳酸钠和水,若没有此装置,则装置D增重偏大,认为生成的二氧化碳质量偏大解答;
(6)根据停止加热后,仍继续通入空气一段时间,目的是使反应生成的二氧化碳全部被D吸收解答;
【含量测定】
(7)根据反应前后固体减少的质量为生成的二氧化碳的质量,利用反应的化学方程计算解答;
(8)根据反应原理写出反应的化学方程式解答.
解答 解:
【探究一】(1)根据溶液pH值可知:Na2CO3溶液和NaHCO3溶液显碱性,滴加紫色石蕊试液,均蓝色;溶液的碱性越强,pH越大,NaHCO3溶液<Na2CO3溶液;
(2)碳酸氢钠加热分解为碳酸钠、水和二氧化碳,氢氧化钙和二氧化碳反应生成碳酸钙和水,反应的化学方程式为:CO2+Ca(OH)2═CaCO3↓+H2O;在受热条件下,碳酸钠比碳酸氢钠稳定性强;
(3)20℃时碳酸钠和碳酸氢钠的溶解度分别为21.5g和9.6g,那么在该温度下,10g水中最多溶解2.15g碳酸钠达到饱和,最多溶解0.96g碳酸氢钠达到饱和,因此可分别加入2g固体,充分搅拌后,若完全溶解则为碳酸钠,若不能完全溶解则为碳酸氢钠;故填:A;
【探究二】
(4)实验前先通一段时间的空气的目的是排尽装置内的空气(或二氧化碳);
(5)气经过装置A时,其中的二氧化碳与氢氧化钠反应生成碳酸钠和水,若没有此装置,则装置D增重偏大,认为生成的二氧化碳质量偏大;造成测定结果偏大;
(6)停止加热后,仍继续通入空气一段时间,目的是使反应生成的二氧化碳全部被D吸收;
【含量测定】
(7)设10.0g样品中含碳酸氢钠的质量x
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
168 44
x 124.4g-122.2g
$\frac{168}{x}=\frac{44}{124.4g-122.2g}$
x=8.4g
该样品中碳酸氢钠的质量分数为$\frac{8.4g}{1g}$
×100%=84%
(8)向Na2CO3溶液中通入CO2气体可以生成NaHCO3,该反应的化学反应方程式为:Na2CO3+CO2+H2O═2NaHCO3
故答案:
【探究一】
(1)蓝色;<
(2)CO2+Ca(OH)2═CaCO3↓+H2O;强;
(3)A;
【探究二】
【问题讨论】
(4)排尽装置内的空气(或二氧化碳);
(5)吸收鼓入空气中的二氧化碳,偏大
(6)使反应生成的二氧化碳全部被D吸收.
【含量测定】
(7)该样品中碳酸氢钠的质量分数为84%
【知识拓展】
(8)Na2CO3+CO2+H2O═2NaHCO3
点评 本题考查碳酸氢钠含量的测定实验,为高频考点,把握实验装置的作用及实验目的为解答的关键,侧重分析、计算及实验能力的综合考查,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:多选题
| A. | 长期盛放石灰水后留下的白色物质 | |
| B. | 氢气还原氧化铜后附着的红色物质 | |
| C. | 氢氧化钠溶液和氯化铁溶液反应后的红褐色物质 | |
| D. | 氯化钠溶液和硝酸银溶液产生的白色沉淀 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氧气在空气中的含量约为50% | |
| B. | 氧气可以支持燃料,但不具有可燃性 | |
| C. | 铁在氧气中燃烧生成FeO | |
| D. | 氧气的密度比空气小 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
 A、B、C、D、E分别为初中化学常见的物质,它们之间的反应或转化关系如图所示(部分物质和反应条件已略去),其中A是一种碱,E为Fe,C是人体胃液中的主要成分,B是石灰石的主要成分,请回答下列问题.
A、B、C、D、E分别为初中化学常见的物质,它们之间的反应或转化关系如图所示(部分物质和反应条件已略去),其中A是一种碱,E为Fe,C是人体胃液中的主要成分,B是石灰石的主要成分,请回答下列问题.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 物质 | 所含杂质 | 除去杂质的方法 | |
| A | CO | CO2 | 将气体缓缓通过足量的澄清石灰水,并干燥 |
| B | CO2 | CO | 将混合气体点燃 |
| C | Cu | Zn | 加入过量的稀盐酸,过滤,洗涤,加热烘干 |
| D | FeCl2溶液 | CuCl2 | 加入过量的铁粉,过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
 已知A-F是初中化学常见物质,其中C、E、F为单质,A、B、D为氧化物且A、B、C都是空气的成分,E是红色固体,F是目前产量最高的金属,它们之间有如图所示的反应与转化关系(图中“-”表示两种物质能反应,“→”表示转化关系).
已知A-F是初中化学常见物质,其中C、E、F为单质,A、B、D为氧化物且A、B、C都是空气的成分,E是红色固体,F是目前产量最高的金属,它们之间有如图所示的反应与转化关系(图中“-”表示两种物质能反应,“→”表示转化关系).查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 塑料、合成纤维、合成橡胶都属于合成有机高分子材料 | |
| B. | 天然气的主要成分是甲烷,其化学式为CH4,由此可知甲烷中有4个氢原子 | |
| C. | 某温度下的两种溶液,溶质质量分数相同,则该温度下这两种物质的溶解度相同 | |
| D. | 纤维素属于糖类,不能被人体消化吸收,故我们不需要摄入含纤维素的食物 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 废液的来源 | 甲组 | 乙组 |
| 检测方法与结果 | 观察废液为无色 | 观察废液呈红色 |
| A. | 直接将甲组的废液排入铸铁管下水道,可能会腐蚀铸铁水管 | |
| B. | 乙组废液中一定含有氢氧化钠、氯化钠、硫酸钠 | |
| C. | 甲组废液中一定含有稀盐酸和稀硫酸 | |
| D. | 将两组的废液处理后再排放,防止污染 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com