
【题目】同学们通过学习知道铜与盐酸、稀硫酸不能发生反应,但却发现化学老师用铜与浓硝酸制备出了NO2气体去做物理实验。同学们对此很感兴趣,在实验室对铜与硝酸的反应进行了探究。
实验I | 实验II | ||
实验装置 | 实验现象 | 实验装置 | 实验现象 |
| 铜片逐渐消失, 有无色气泡产生,试管中上部有红棕色气体出现;溶液由无色变为蓝色 |
| 铜片逐渐消失, 产生红棕色气体,溶液由无色变为绿色 |
(探究一)实验I中产生的无色气体是什么?
(查阅资料)
(1)硝酸(HNO3)与Cu反应生成硝酸铜和含氮元素的化合物;硝酸铜溶液呈蓝色
(2)含氮元素的某些气态物质的物理性质
NH3 | NO | NO2 | |
颜色 | 无色 | 无色 | 红棕色 |
气味 | 刺激性 | 刺激性 | |
溶解性 | 极易溶于水 | 难溶于水 | 可溶于水或硝酸 |
(3)NO2与水反应生成无色的硝酸和NO气体
(猜想与假设)无色气体可能是:①NH3 ②NO
(进行实验)同学们利用下图装置对产生的无色气体进行检验。
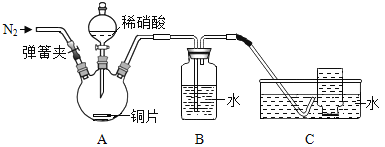
实验操作 | 实验现象 |
1. 打开弹簧夹,通入N2,一段时间后,关闭弹簧夹 | B、C中导管口有无色气泡冒出 |
2. 将C中导管伸入集气瓶中,打开分液漏斗的活塞,滴入一定量稀硝酸,关闭活塞 | A中有无色气泡产生 B中导管口有无色气泡冒出 C中集气瓶内收集到无色气体 |
3. 从水槽中取出集气瓶,敞口置于空气中 | 无色气体变为红棕色 |
4. 取少量B中液体于试管中,滴加无色酚酞溶液 | 试管中溶液颜色无明显变化 |
(解释与结论)
(1)操作1中,通入N2的目的是_____。
(2)同学们认为猜想①不正确,理由是_____。
(3)无色气体具有的化学性质是_____。
(探究二)为什么实验II中的溶液呈绿色而不是蓝色?
(猜想与假设)①溶液中硝酸铜的质量分数较高②硝酸铜溶液中溶解了生成的气体
(设计实验)同学们设计了以下4个实验方案。
方案1 | 配制饱和硝酸铜溶液并稀释至不同的浓度,观察溶液颜色变化 |
方案2 | 加水稀释实验II所得的绿色溶液,观察溶液颜色变化 |
方案3 | 取实验II所得的绿色溶液,加热,观察溶液颜色变化 |
方案4 | 配制饱和硝酸铜溶液,…… |
(反思与评价)
(1)“方案1”和“方案3”中,能验证猜想②的是_____。
(2)“方案2”不能验证猜想①的原因是_____。
(3)“方案4”也可验证猜想②,该方案是:配制饱和硝酸铜溶液,_____。
(4)通过实验I、II与已有知识的对比,可得出的结论是_____(答一条即可)。
【答案】排出装置中的空气,防止干扰 B中液体加酚酞溶液不变色,说明不是氨气 能与氧气反应 方案3 方案2中加水既改变了硝酸铜溶液的质量分数,又能与NO2反应,不能验证猜想① 通入NO2气体,观察溶液颜色的变化 硝酸浓度不同,产物不同
【解析】
探究一 解释与结论:
(1)操作1中,通入N2的目的是赶走装置中的空气,防止干扰。故填:排出装置中的空气,防止干扰。
(2)同学们认为猜想①氨气不正确,理由是氨气遇到水会反应生成氨水,氨水呈碱性,遇到酚酞会是无色酚酞变红,而B中液体加酚酞溶液不变色,说明不是氨气。故填:B中液体加酚酞溶液不变色,说明不是氨气。
(3)从水槽中取出集气瓶,敞口置于空气中,无色气体变为红棕色,说明无色气体能与氧气反应。故填:能与氧气反应。
探究二 反思与评价:
(1)“方案1”变量是不同的浓度硝酸铜溶液,可验证猜想探究一,“方案3” 取实验II所得的绿色溶液,加热,加热前后颜色对比,能验证猜想②。故填:方案3。
(2)根据资料可知,二氧化氮能与水反应,而“方案2”中加水既改变了硝酸铜的质量分数,又能与二氧化氮反应,不能验证猜想①。故填:方案2中加水既改变了硝酸铜溶液的质量分数,又能与NO2反应,不能验证猜想①。
(3)猜想②硝酸铜溶液中溶解了生成的气体,“方案4”要验证猜想②,必须控制有无NO2气体做对比,所以该方案是:配制饱和硝酸铜溶液,通入NO2气体,观察溶液颜色的变化。故填:配制饱和硝酸铜溶液,通入NO2气体,观察溶液颜色的变化。
(4)通过实验I、II与已有知识的对比,铜分别与稀硝酸和浓硝酸反应时产生的物质不同,可得出的结论是:硝酸浓度不同,产物不同。故填:硝酸浓度不同,产物不同。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:
【题目】某化学兴趣小组的同学在进行“活泼金属与酸的反应”实验时,对铝和铝的化合物的性质进行了探究。
[性质探究]
I.金属的活动性
甲同学将用砂纸打磨过的铝片放入氯化镁溶液中,____,说明铝的金属活动性排在镁的________。
II.金属与酸的反应
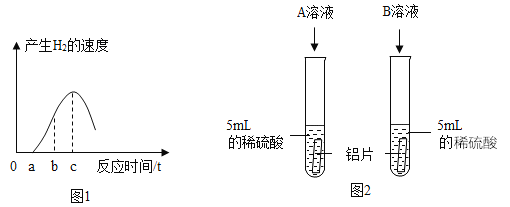
(1)乙同学利用数字传感器测得铝片与稀硫酸反应产生氢气的速度与时间的关系如图1所示,单质铝与稀硫酸反应的化学方程式为__________。图中从0到a这段时间无明显变化的原因是________。
(2)将铝片与浓度相同的足量稀硫酸、稀盐酸反应,结果是生成氢气的速度前者比后者慢很多。丙同学对比盐酸和硫酸的化学式之后,猜想可能是盐酸中的氯离子对反应有促进作用。为了验证是“盐酸中的氯离子对反应有促进作用”的猜想,大家一起设计了如图2所示的实验。如果该实验能证明猜想,加入的B溶液是Na2SO4溶液,依据控制变量的原则,A溶液是_____溶液。
(3)你认为还有可能是___________因素造成的。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】铁(Fe)是应用广泛的活泼金属,能与酸反应、在潮湿的空气中容易生锈。
(1)写出铁和稀硫酸反应的化学方程式:_______________。
(2)铁在潮湿的空气中生锈需经过一系列反应, 完成第一步反应:![]() _________
_________![]()
(3)氢碘酸( HI )是类似于盐酸的一种强酸, 已知:![]() 。完成配比为1:1的H2SO4和HI混合稀溶液溶解Fe(OH)3的总化学反应方程式:_______________。
。完成配比为1:1的H2SO4和HI混合稀溶液溶解Fe(OH)3的总化学反应方程式:_______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小明模拟旅游时汽车穿越山洞的情境,设计了一个游戏。游戏规则:当汽车上的物质与山洞中的物质能发生反应时,汽车才能载着原物质进入下一个山洞。山洞中可供选择的物质有:稀硫酸、碳酸钠、氧化铁、氢氧化钠、镁、二氧化碳。
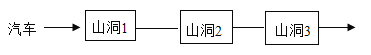
(1)若汽车上的物质是盐酸。
①山洞1中的物质是单质,该物质的化学式是_____。
②山洞2中的物质与盐酸反应后,溶液呈黄色,反应的化学方程式为_____。
③山洞3中的物质可以与盐酸发生复分解反应,产生无色气体。该反应的化学方程式为_____
(2)若汽车上的物质是氢氧化钙。山洞1中的物质为氧化物,则山洞2、3中的物质是____,山洞1中反应的化学方程式为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学小组同学利用下图装置分别完成2个实验。
序号 | 甲 | 乙 | 分液漏斗 |
1 | 大理石 | 澄清石灰水 | 稀盐酸 |
2 | 二氧化锰 | 80℃热水及一小块白磷 | 过氧化氢溶液 |

(1)实验1:打开b和a,将分液漏斗中过量的盐酸注入,关闭a,此时乙中反应的化学方程式是_____,一段时间后,关闭b,观察到乙中液体变澄清,产生此现象的原因是_____。
(2)实验2:观察到乙中白磷的现象是_____;打开b和a,当分液漏斗中的过氧化氢溶液全部注入后,关闭a,观察到乙中白磷的现象是_____。关闭b,一段时间后,白磷的现象及原因是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】钛(Ti)具有硬度大,密度小,熔点高,抗腐蚀性好等优良性能,被誉为“未来金属”。现有5种含钛元素的物质:Ti、TiO2、Ti2O3、TiCl4、K2TiO3。回答下列问题:
(1)TiCl4读作_____________。
(2)从物质分类的角度看,K2TiO3属于_______ 。(填选项)
A 氧化物 B 酸 C 碱 D 盐
(3)Ti2O3在加热条件下可溶于硫酸,生成Ti2(SO4)3 ,反应的化学方程式为______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据给出的KNO3和NaCl两种物质的溶解度表及溶解度曲线,回答问题。

温度/°C | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.7 |
KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 | |
(1)在60℃时,NaCl的溶解度为_____g。
(2)30℃时,硝酸钾饱和溶液和氯化钠饱和溶液各100g,分别蒸发掉10g水,恢复至30℃时,_____饱和溶液析出的晶体多。
(3)要将KNO3从其饱和溶液中全部结晶出来,应该采用的方法是_____(填“冷却热饱和溶液”或“蒸发溶剂”)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】利用钛精矿(主要成分为TiO2)制备金属钛(Ti)的主要工艺流程如下:

(1)TiO2中钛元素的化合价是______。
(2)反应釜中搅拌的目的是______。
(3)推测反应釜废气中含CO,从元素守恒角度说明理由:______。
(4)合成器中发生反应的化学方程式是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com