
(10分)在研究“铁生锈的条件”的实验中,某兴趣小组对实验进行了创新设计,请把实验报告补充完整.
取3段光亮无锈的细铁丝,绕成螺旋状,放入3支干燥洁净的试管底部,进行下列实验,实验要保证有足够长的时间来观察现象.
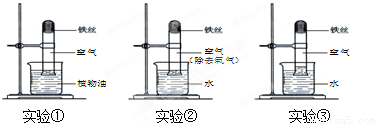
(1)实验①②无明显现象,实验③中铁丝生锈,且试管内空气体积减小.铁生锈实际上是铁与空气中的_______和_______(填物质名称)发生反应的结果。
(2)当铁丝足量,时间足够长,实验③进入试管的水的体积大约占试管体积的_________。
(3)金属资源储量有限且不能再生,为了保护金属资源,你还有什么合理的建议_____________________________________________(填一点)
(4) 根据铁生锈的原理和条件,你认为新疆和海南岛的钢铁,哪里的更容易生锈?_____________________________。
(1)水和氧气 (2)五分之一或者21%
(3)废旧金属回收或者节约金属 (4)海南岛
【解析】
试题分析:(1)根据铁生锈的条件进行分析,铁在潮湿的空气中易生锈;再结合实验①②无明显现象(①中没有水,②中没有氧气),实验③中铁丝生锈(有水和氧气),且试管内空气体积减小,可知铁生锈实际上是铁与空气中的水和氧气作用的结果。
(2)若铁丝足量,时间足够长,则试管内空气中的氧气会全部被消耗完,而根据空气的成分及各成分的体积分数可知,空气中氧气的体积约占1/5,故实验③中进入试管的水的体积大约占试管体积的1/5。
(3)金属资源的保护主要有四种措施:①减缓或防止金属的腐蚀,②回收利用废旧金属,③有计划、合理地开采矿物,④寻找金属的代用品,合理即可。
(4)根据铁生锈的原理和条件分析,海南岛的钢铁应该更易生锈,因为新疆的气候干燥缺水,而海南岛的气候潮湿,更易生锈。
考点:金属锈蚀的条件及其防护,空气的成分及各成分的体积分数,金属资源的保护
点评:理解和熟记有关金属锈蚀的条件及其防护措施等相关知识,是解答本题的关键。


科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:


查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com