

| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| 溶解度/g | 14.3 | 17.4 | 20.7 | 25 | 28.5 | 33.3 | 40 | 55 | 75.4 |


分析 (1)高温条件下,碳酸钙分解生成氧化钙和二氧化碳;
(2)加热条件下,铜和氧气反应生成氧化铜,氧化铜和稀硫酸反应生成硫酸铜和水;
(3)饱和溶液溶质质量分数=$\frac{溶解度}{100g+溶解度}$×100%;
(4)氧化钙和水反应生成氢氧化钙,氢氧化钙和硫酸铜反应生成氢氧化铜沉淀和硫酸钙;
(5)氢氧化钠溶液能够吸收空气中的二氧化碳;
浓硫酸具有吸水性,可以用作氢气、氧气、二氧化碳等气体的干燥剂;
(6)冷却后装置D增重1.8g,说明反应生成了1.8g水,装置E增重8.8g,说明反应生成了8.8g二氧化碳,从而可以计算反应生成氧化铜的质量,进一步可以进行相关方面的计算和判断;
(7)碱石灰能够吸收水蒸气和二氧化碳;
(8)根据提供的数据可以计算、判断物质的化学式;
(9)无水硫酸铜是白色固体;
(10)将CuSO4•5H2O固体加热到570℃分解后,生成氧化铜、三氧化硫和水.
解答 解:(1)流程图中X的化学式为CO2.
故填:CO2.
(2)反应②分两步进行,化学方程式分别为:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO、CuO+H2SO4═CuSO4+H2O.
故填:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO;CuO+H2SO4═CuSO4+H2O.
(3)析出晶体后的溶液是饱和溶液,温度到达30℃时,硫酸铜的溶解度是25g,剩余硫酸铜溶液的溶质质量分数为:$\frac{25g}{100g+25g}$×100%=20%;
用冰水洗涤的目的是:Ⅰ是除去晶体表面的杂质;Ⅱ是0℃时硫酸铜溶解度小,损失少.
故填:20%;0℃时硫酸铜溶解度较小,损失少.
(4)反应④中硫酸铜、生石灰和水制备波尔多液,其化学方程式为:Ⅰ是氧化钙和水反应生成氢氧化钙,反应的化学方程式为:CaO+H2O═Ca(OH)2;Ⅱ是氢氧化钙和硫酸铜反应生成氢氧化铜沉淀和硫酸钙,反应的化学方程式为:Ca(OH)2+CuSO4=CaSO4+Cu(OH)2↓.
故填:CaO+H2O═Ca(OH)2;Ca(OH)2+CuSO4=CaSO4+Cu(OH)2↓.
(5)洗气瓶A中氢氧化钠溶液的作用是除去空气中的二氧化碳;B中所装液体为浓硫酸.
故填:除去空气中的二氧化碳;浓硫酸.
(6)解:装置D增重1.8g,说明生成了1.8g水,装置E增重8.8g,说明生成了8.8g二氧化碳,
则反应生成氧化铜质量为:34.6g-1.8g-8.8g=24g,
aCuCO3•bCu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$(a+b)CuO+bH2O+aCO2↑,
80(a+b) 18b 44a
24g 1.8g 8.8g
$\frac{80(a+b)}{24g}$=$\frac{18b}{1.8g}$=$\frac{44a}{8.8g}$,
a:b=2:1.
故填:2:1.
(7)若缺少F装置,空气中的水蒸气和二氧化碳会进入E中,导致测定的二氧化碳质量偏大,从而导致测得的a:b的值会偏大.
故填:偏大.
(8)设G点固体的化学式是CuSO4•xH2O,
根据题意有:CuSO4•5H2O$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4•xH2O+(5-x)H2O,
160+18x 18(5-x)
1.78g 0.72g
$\frac{160+18x}{1.78g}$=$\frac{18(5-x)}{0.72g}$,
x=1,
故填:CuSO4•H2O.
(9)H点所得固体是无水硫酸铜,无水硫酸铜的颜色是白色的.
故填:白色.
(10)将CuSO4•5H2O固体加热到570℃分解后,得到的主要产物是氧化铜、三氧化硫和水,反应的化学方程式为:CuSO4•5H2O$\frac{\underline{\;\;△\;\;}}{\;}$CuO+SO3↑+5H2O↑.
故填:CuSO4•5H2O$\frac{\underline{\;\;△\;\;}}{\;}$CuO+SO3↑+5H2O↑.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.


科目:初中化学 来源: 题型:选择题
| A. |  测定空气中氧气的含量 | B. |  加热后、闻气体的气味 | ||
| C. | 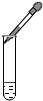 向试管中滴加液体 | D. | 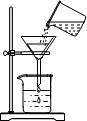 过滤 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
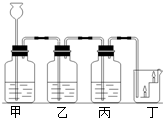 如图是某同学设计的实验装置,请你回答下列问题:
如图是某同学设计的实验装置,请你回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 电解水:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑ | |
| B. | 焦炭与水蒸气反应:C+H2O$\frac{\underline{\;高温\;}}{\;}$H2+CO | |
| C. | 太阳光分解水:2H2O$\frac{\underline{太阳能}}{催化剂}$2H2↑+O2↑ | |
| D. | 天然气与水反应:CH4+H2O$\frac{\underline{\;高温\;}}{\;}$CO+3H2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 化学电池是一类重要的能源,废旧电池中的许多物质是可以回收利用的.某种型号的干电池的剖面图如图所示.现对其中的填充物(MnO2、C、可溶性填充物)进行探究,请填空:
化学电池是一类重要的能源,废旧电池中的许多物质是可以回收利用的.某种型号的干电池的剖面图如图所示.现对其中的填充物(MnO2、C、可溶性填充物)进行探究,请填空:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用洗洁精除去衣服上的油污 | |
| B. | 用灼烧法鉴别真假羊毛衫 | |
| C. | 50mL水和50mL酒精混合后,总体积小于100mL是因为分子在不断运动着 | |
| D. | 严禁焚烧秸秆,降低空气中PM2.5的浓度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com