
| 氧化铁 | 氧化铝 | 氧化铜 | 氧化镁 | |
| 开始反应 | 420 | 515 | 305 | 490 |
| 剧烈反应 | 490 | 540 | 350 | 545 |
分析 【查阅资料】对比表格中的数据选择合适的催化剂;
【设计并完成实验】根据控制变量的实验方法来分析;
【结论】根据化学反应的原理以及化学方程式的写法来分析;
【实验反思】(1)根据控制变量的实验方法来分析;
(2)根据在相同温度下,比较两组实验产生O2的快慢可采用测相同时间内产生O2的体积或收集相同体积O2所需的时间进行解答.
解答 解:【查阅资料】根据表格中的数据可知,加入催化剂后氯酸钾分解温度最低的是氧化铜,所以实验室用氯酸钾制取氧气,如果不用二氧化锰作催化剂,最好选用的氧化物是氧化铜;故填:氧化铜;
【实验现象分析】为了对比催化剂的催化效果,选取的氯酸钾质量应该相等,也应该取3.0g;实验I中是3.0g氯酸钾,实验Ⅲ中是3.0g氯酸钾与1.0g氧化铜,两个实验比较可证明CuO改变KClO3分解的速率;故填:3.0;CuO改变KClO3分解的速率;
【结论】氯酸钾在氧化铜作催化剂,加热的条件下分解为氯化钾和氧气;故填:2KClO3$\frac{\underline{\;CuO\;}}{△}$2KCl+3O2↑;
【实验反思】(1)实验Ⅱ和Ⅲ的区别是催化剂的种类不同,这两组实验对比可以看出CuO对KClO3催化效果是否比MnO2好;故填:CuO对KClO3催化效果是否比MnO2好;
(2)在相同温度下,比较两组实验产生O2的快慢可采用测相同时间内产生O2的体积或收集相同体积O2所需的时间;
故填:①相同时间内收集氧气的体积大小;②收集相同体积氧气所需要时间长短(或其他合理答案).
点评 此题考查气体制备过程中催化剂的选择问题,催化剂能改变化学反应速率,对于有气体生成的反应,反应速率的快慢可以通过收集相同体积的气体所用时间的长短来体现.


科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 如图所示,玻璃管中有色液体的左右移动可反映出瓶内气体温度的变化.当向盛有水的试管中加入少量的固体氢氧化钠时,发现有色液体向右移动,这说明氢氧化钠固体溶于水放热.而当向盛有水的试管中加入少量的硝酸铵时,发现有色液体向左移动,这又说明了硝酸铵固体溶于水吸热.
如图所示,玻璃管中有色液体的左右移动可反映出瓶内气体温度的变化.当向盛有水的试管中加入少量的固体氢氧化钠时,发现有色液体向右移动,这说明氢氧化钠固体溶于水放热.而当向盛有水的试管中加入少量的硝酸铵时,发现有色液体向左移动,这又说明了硝酸铵固体溶于水吸热.查看答案和解析>>
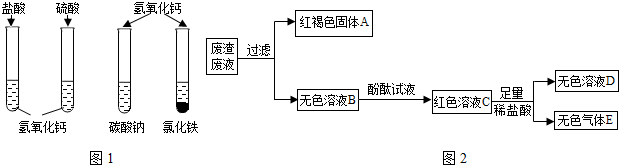
科目:初中化学 来源: 题型:实验探究题
| 气体 | 反应前的药品状态 | 反应条件 | 气体性质 |
| 甲 | 固体+液体 | 常温 | 不与水反应,不易溶于水,密度比空气大 |
| 乙 | 固体+固体 | 加热 | 能与水发生反应,极易溶于水,密度比空气小 |
| 丙 | 固体+液体 | 加热 | 能与水发生反应,能溶于水,密度比空气大 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题


查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
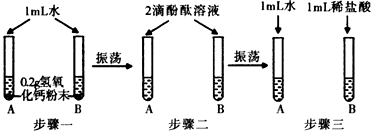
| 实验操作 | 实验现象 | 实验结论 |
| 取步骤三B试管中溶液样品倒入盛有锌粒的试管中 | 产生气泡 | 猜想一正确 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 某固体物质中加入稀盐酸,产生大量气泡,该物质一定是碳酸盐 | |
| B. | 某溶液中加入氯化钡溶液和稀硝酸,产生白色沉淀,该溶液中一定含有硫酸根离子 | |
| C. | 某溶液用pH 试纸测试,试纸变蓝色(pH 约为10 ),该溶液一定是碱性溶液 | |
| D. | 稀盐酸与氢氧化钠反应后滴加无色酚酞试液不变色,可以断定两者恰好完全反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 实验操作 | 现象 | 结论 | |
| A | 向盛有少量无色溶液的试管中滴加酚酞试液 | 溶液变红 | 该溶液一定呈碱性 |
| B | 向盛有少量无色溶液的试管中滴加氯化钡溶液 | 出现白色沉淀 | 该溶液中一定含有硫酸根离子 |
| C | 向盛有少量固体的试管中滴加稀盐酸 | 产生气泡 | 该固体一定含有碳酸盐 |
| D | 点燃某气体,在火焰上方罩一个 干冷的烧杯 | 烧杯内壁出现水珠 | 该气体一定是氢气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com