
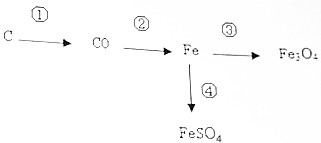
 利用如图所示的转化关系,请回答:
利用如图所示的转化关系,请回答:分析 (1)根据碳不充分燃烧生成一氧化碳,易造成煤气中毒,进行分析解答.
(2)根据质量守恒定律,反应前后铁元素的质量不变,进行分析解答.
(3)转化③是铁在氧气中燃烧,结合实验的注意事项,进行分析解答.
(4)转化④,是铁转化为硫酸亚铁,结合金属的化学性质,进行分析解答.
解答 解:(1)碳不充分燃烧生成一氧化碳,易造成煤气中毒,用燃煤取暖时,防止转化①的发生,应注意室内通风.
(2)由质量守恒定律,反应前后铁元素的质量不变,用100t含氧化铁80%的赤铁矿石,理论上能得到铁的质量为100t×80%×$\frac{56×2}{56×2+16×3}×$100%=56t.
(3)转化③是铁在氧气中燃烧生成四氧化三铁,在实验室中顺利完成转化③,为防止生成物熔化溅落下来使瓶底炸裂,应注意集气瓶的底部应放少量的水或铺一层细沙(合理即可).
(4)转化④,是铁转化为硫酸亚铁,铁能与稀硫酸反应生成硫酸亚铁和氢气,能与硫酸铜溶液反应生成硫酸亚铁溶液和铜,故加入的试剂可能是稀硫酸或硫酸铜溶液等.
故答案为:(1)室内通风;(2)56;(3)集气瓶的底部应放少量的水或铺一层细沙(合理即可);(4)稀硫酸(或硫酸铜等).
点评 本题难度不大,掌握碳的化学性质、金属的化学性质、质量守恒定律等并能灵活运用是正确解答本题的关键.


 小夫子全能检测系列答案
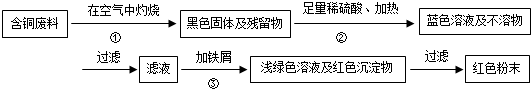
小夫子全能检测系列答案科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 铁 铜 金 | B. | 金 铜 铁 | C. | 铜 铁 金 | D. | 铁 金 铜 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 镁在空气中燃烧,其固体质量变化可用图表示,则(20-12)g表示的质量是( )
镁在空气中燃烧,其固体质量变化可用图表示,则(20-12)g表示的质量是( )| A. | 生成物MgO的质量 | |
| B. | 参加反应的Mg的质量 | |
| C. | 参加反应的氧气的质量 | |
| D. | 生成物MgO与参加反应的O2的质量和 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 1号瓶 (收集34%的氧气) | 2号瓶 (收集35%的氧气) | 3号瓶 (收集36%的氧气) | 4号瓶 (收集37%的氧气) |
| 不复燃 | 不复燃,但很亮 | 很亮,复燃 | 立即复燃 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
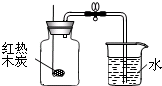 小军根据燃烧红磷测定空气中氧气含量的实验原理,认为可用木炭代替红磷测定空气中氧气的含量,并按右图装置进行实验.他依据的实验原理可能是木炭燃烧消耗氧气.
小军根据燃烧红磷测定空气中氧气含量的实验原理,认为可用木炭代替红磷测定空气中氧气的含量,并按右图装置进行实验.他依据的实验原理可能是木炭燃烧消耗氧气.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com