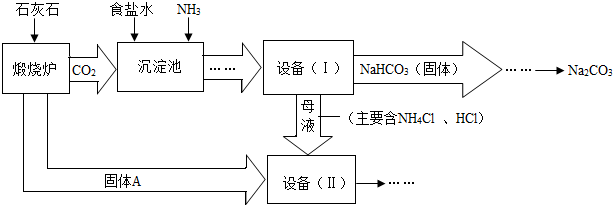
解:(1)碳酸钙在高温下分解生成二氧化碳气体和氧化钙,方程式为:CaCO
3
CaO+CO
2↑;
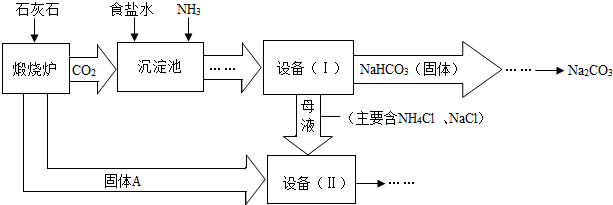
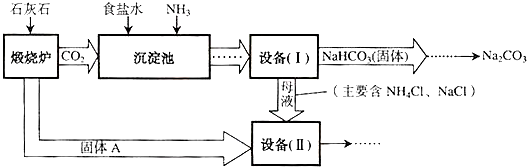
(2)过滤是把不溶于液体的固体和液体分开的一种分离混合物的方法,“设备(I)”中的液体混合物中分离出析出的晶体,故可用过滤的方法;过滤用到的玻璃仪器有烧杯、漏斗、玻璃棒;
(3)氧化钙与水反应生成氢氧化钙,方程式为:H
2O+CaO=Ca(OH)
2;
(4)进入“设备(Ⅱ)”的物质有氧化钙、氯化钠、氯化铵及水,发生的反应有H
2O+CaO=Ca(OH)
2、Ca(OH)
2+2NH
4Cl=2NH
3↑+2H
2O+CaCl
2,最终产物有氯化钠、氯化钙、氨气,其中氯化钠、氨气可再利用;
(5)纯碱是一种重要的关于用品,可用于玻璃、造纸、纺织或洗涤剂的生产等;
故答案为:
(1)CaCO
3
CaO+CO
2↑;
(2)过滤;漏斗、玻璃棒;
(3)H
2O+CaO=Ca(OH)
2;
(4)NH
3、NaCl;
(5)用于玻璃、造纸、纺织或洗涤剂的生产等.
分析:(1)根据碳酸钙高温分解的化学性质回答;
(2)根据过滤的原理和适用范围、以及所用的仪器回答;
(3)根据氧化钙的化学性质书写方程式;
(4)根据“设备(Ⅱ)”中发生的反应和流程图中可循环使用的物质回答;
(5)根据纯碱的用途回答.
点评:本题看起来起点很高,但落点较低,考查了学生对知识的理解和应用,也充分体现了化学来源于生产、生活,又服务于生产、生活的理念.

 CaO+CO2↑;
CaO+CO2↑; CaO+CO2↑;
CaO+CO2↑;