
| 操作步骤 | 现象与结论及有关化学方程式 |
| ______ | ______ |
| 操作步骤 | 现象与结论及有关化学方程式 |
| ①分别取少量液体于试管中,分别滴加石蕊试液,振荡; ②向变红色的两支试管中滴加BaCl2溶液,振荡; ③向不变色的两支试管中滴加AgNO3溶液,振荡. |
溶液变红的是硫酸或盐酸,溶液变蓝的是氢氧化钠溶液,溶液不变色的是氯化钠溶液或水; 产生白色沉淀的是硫酸,没有的是盐酸; H2SO4+BaCl2═BaSO4↓+2HCl 产生白色沉淀的是氯化钠溶液,没有的是水. NaCl+AgNO3═AgCl↓+NaNO3 |


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
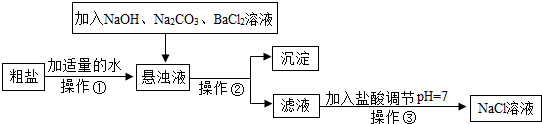

| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
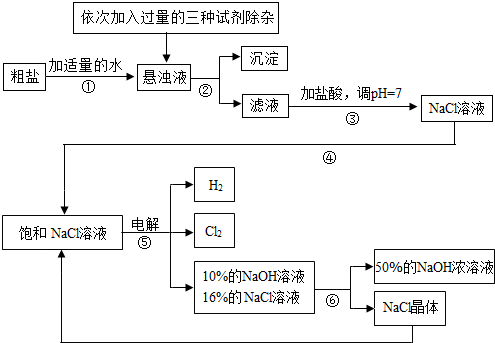
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:初中化学 来源:《第8单元 生活中的酸碱盐》2011年单元测试卷(江阴高级中学)(解析版) 题型:选择题
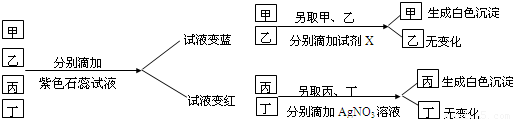
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com