20.某兴趣小组以老师提供的如图甲实验装置为主进行如下兴趣实验.(试剂均足量,假设各步反应均完全,装置可重复使用,部分夹持装置已省略,组合装置气密性良好.)
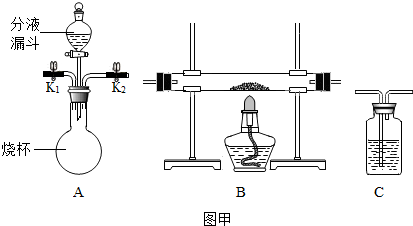
【探究一】甲组同学利用A装置来分离CO和CO
2的混合气体(气流从K
1进入装置).
(1)在烧瓶内装入足量的NaOH溶液,分液漏斗中可装入适量稀硫酸,先关闭分液漏斗活塞,打开活塞K
1和K
2通入混合气体时,可先分离得到CO,再关闭K
1,打开分液漏斗活塞使液体流下,反应后可再得到CO
2,若要使实验成功,装置必需进行的改进措施是将A装置内左侧导管伸入液面下.
【探究二】甲组同学利用A装置制备O
2,并利用制得的O
2验证B中的黑色粉末是炭粉.
(2)A中反应的化学方程式是2H
2O
2 $\frac{\underline{\;MnO_2\;}}{\;}$2H
2O+O
2↑.
(3)为完成此实验,除用装置A、B外,还需要补充的装置有C(填装置序号),该装置中应盛澄清石灰水(填药品名称),实验中可观察到该装置中的现象是澄清石灰水变浑浊,该装置中发生反应的化学方程式为Ca(OH)
2+CO
2 =CaCO
3↓+H
2O.
【探究三】若A装置中烧瓶内的气体可能是CO、CO
2、CH
4中的一种或几种,为确定烧瓶内气体的成分,乙组同学进行如下实验:
CH
4与CuO在加热条件下反应,生成一种金属单质、二氧化碳和水.
Ⅰ.装置B的玻璃管中盛入足量的CuO固体;
Ⅱ.将3.0g的NaOH浓溶液滴入烧瓶中,充分反应;
Ⅲ.按A→C
1→B→C
2→…的顺序连接装置,打开K
1,从K
1处通入氮气,打开K
2,排尽B装置中空气,加热B装置中足量的CuO固体,充分反应;
Ⅳ.反应结束后,测得烧瓶中溶液的质量为3.1g,B装置中固体的质量减少了0.48g,第二个C装置的质量增加了0.18g.
(4)写出CH
4与CuO反应的化学方程式CH
4 +4CuO $\frac{\underline{\;\;△\;\;}}{\;}$ 4Cu+CO
2+2H
2O.
(5)打开K
2前应先从K
1处通入氮气,否则易产生倒吸现象.两个装置C中试剂相同,装置C中的试剂名称是浓硫酸,通过数据分析,烧瓶中气体的成分是CO
2、CO和CH
4.
【探究四】丙组同学为探究“氧化铁和铜粉”混合物中氧化铁的质量分数,又增加了必要仪器,先称取一定量样品,按如图乙实验装置进行实验:
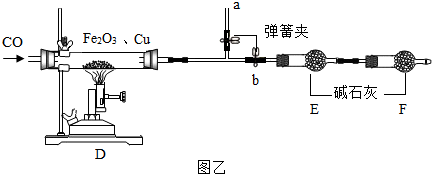
(6)D装置中用于加热的实验仪器的名称是酒精喷灯,装置D中发生反应的化学方程式为Fe
2 O
3 +3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO
2.该实验的一个明显缺陷是缺少尾气处理装置.
(7)若要利用下列有关数据来测定样品中氧化铁的质量分数(假设反应均完全),最少需要测定下列数据中的2个数据,选择下列最少的数据,最多有3种方案能计算出样品中氧化铁的质量分数.
①通入玻璃管的CO体积V ②原样品质量m
1 ③完全反应后玻璃管内固体质量m
2 ④反应前后E增重的质量m
3(8)小王同学利用丙组所做实验中充分反应后的管内固体X进行如图丙实验:
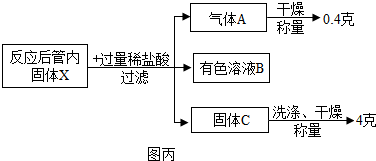
①固体X与稀盐酸反应的化学方程式为:Fe+2HCl=FeCl
2+H
2↑;
②有色溶液B中的溶质为FeCl
2和HCl(填化学式);
③小王根据自己的实验数据,计算原混合物“氧化铁和铜粉”中铜的质量分数为20%.
(9)小李设计了另一简单的方案,取一定量氧化铁与铜粉的混合物样品,直接加入足量稀盐酸,充分反应后,过滤,将滤渣洗涤、干燥后再称量,即为样品中铜的质量.




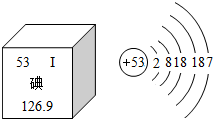 随着日本福岛核电站放射性碘泄露,碘这种元素被人们所认知,如图是元素周期表中提供的碘元素的部分信息及碘原子的结构示意图,下列说法错误的是( )
随着日本福岛核电站放射性碘泄露,碘这种元素被人们所认知,如图是元素周期表中提供的碘元素的部分信息及碘原子的结构示意图,下列说法错误的是( )