
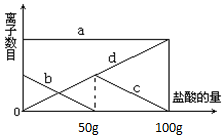
 小明同学在实验室中向25g含有不溶于酸的杂质的碳酸钾配置成溶液,溶液中缓慢地滴加10%的稀盐酸,并不断搅拌,发现开始没产生气泡,盐酸加到一定程度才产生气泡,经查询资料后得知,碳酸钾与盐酸反应先生成碳酸氢钾和氯化钾,随着盐酸的加入,碳酸氢钾再和盐酸反应生成氯化钾释放二氧化碳.随着盐酸的加入,溶液中离子数目也相应地发生变化.如图所示,四条曲线分别与溶液中的四种离子的对应
小明同学在实验室中向25g含有不溶于酸的杂质的碳酸钾配置成溶液,溶液中缓慢地滴加10%的稀盐酸,并不断搅拌,发现开始没产生气泡,盐酸加到一定程度才产生气泡,经查询资料后得知,碳酸钾与盐酸反应先生成碳酸氢钾和氯化钾,随着盐酸的加入,碳酸氢钾再和盐酸反应生成氯化钾释放二氧化碳.随着盐酸的加入,溶液中离子数目也相应地发生变化.如图所示,四条曲线分别与溶液中的四种离子的对应分析 (1)碳酸钾与稀盐酸反应生成氯化钾、水和二氧化碳,
(2)因考虑K2CO3在溶液中电离出K+和CO32-,盐酸溶液中存在H+、Cl-,因而出现CO32-+ H+═HCO3-,然后HCO3-+ H+═H2O+CO2,因向一定量的K2CO3溶液中缓慢地滴加稀盐酸,即出现如图现象.
(3)根据盐酸的质量和质量分数结合方程式计算碳酸钾的质量,进一步计算碳酸钾样品的质量分数.
解答 解:(1)碳酸钾与稀盐酸反应生成氯化钾、水和二氧化碳,化学方程式为:K2CO3+2HCl═2KCl+H2O+CO2↑.故填:K2CO3+2HCl═2KCl+H2O+CO2↑.
(2)因在碳酸钾溶液中K2CO3═2K++CO32-,所以溶液开始就存在K+和CO32-并且K+和CO32-的个数比为2:1,根据图象显示,CO32-+ H+═HCO3-因而CO32-不断减少,因而a 为 K+,b 为 CO32-. 盐酸加到一定程度才产生气泡是因为碳酸开始分解的缘故,生成的KCl在溶液中仍存在Cl-;因而Cl-在图象中随着加盐酸就出现了,所以d必代表Cl-.随着碳酸的不断分解,HCO3-逐渐减少直到消失.因而c必代表HCO3-.故选:D.
(3)设碳酸钾的质量为x
K2CO3+2HCl═2KCl+H2O+CO2↑
138 73
x 100g×10%
$\frac{138}{x}=\frac{73}{100g×10%}$
x≈18.9g
碳酸钾样品的质量分数为$\frac{18.9g}{25g}×100%$=75.6%.
答:碳酸钾样品的质量分数为75.6%.
点评 题既考查学生对酸的性质理解运用,有渗透离子反应的实质,还锻炼学生的良好推断能力.可谓难题.


科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
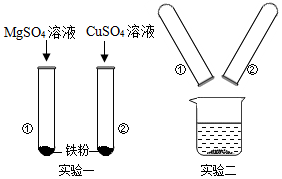
| 实验步骤 | 实验现象 | 结论 |
| 取少量滤渣于试管中,向其中滴加稀盐酸 | 没有气泡产生 | 滤渣中不含有铁 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 市售的碳酸氢钠片是一种白色片状药剂,主要成份为碳酸氢钠(NaHCO3),用于缓解胃酸过多引起的胃痛、胃灼热感(烧心)、反酸等有关症状,根据题意,试回答以下问题:
市售的碳酸氢钠片是一种白色片状药剂,主要成份为碳酸氢钠(NaHCO3),用于缓解胃酸过多引起的胃痛、胃灼热感(烧心)、反酸等有关症状,根据题意,试回答以下问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 分解反应 | B. | 化合反应 | C. | 置换反应 | D. | 复分解反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| ${\;}_{\;}^{1}$H | 2He | ||||||
| 3Li | 4Be | 5B | 6C | 7N | 8O | ① | 10Ne |
| ② | 12Mg | 13Ai | 14Si | 15P | 16S | ③ | 18Ar |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
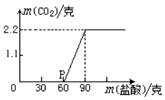 某科学课外活动小组为测定实验室中久置的NaOH的变质程度,先称取17.3克的NaOH样品(杂质为Na2CO3),配成溶液.然后向溶液中逐滴加入质量分数为20%的稀盐酸.根据生成CO2的质量测定Na2CO3的质量,从而进一步确定样品中NaOH的变质程度.回答下列问题
某科学课外活动小组为测定实验室中久置的NaOH的变质程度,先称取17.3克的NaOH样品(杂质为Na2CO3),配成溶液.然后向溶液中逐滴加入质量分数为20%的稀盐酸.根据生成CO2的质量测定Na2CO3的质量,从而进一步确定样品中NaOH的变质程度.回答下列问题查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 温度/℃ | 10 | 30 | 50 | 60 | |
| 溶解度/g | 氯化钠 | 35.8 | 36.3 | 37.0 | 37.3 |
| 硝酸钾 | 20.9 | 45.8 | 85.5 | 110 | |
| A. | 物质的溶解度均随温度的升高而增大或随温度的降低而减少 | |
| B. | 将50℃时的硝酸钾溶液降温10℃,有晶体析出 | |
| C. | 60℃时,往100g水中加入100g硝酸钾,可得到饱和溶液200g | |
| D. | 欲从海水中获取氯化钠,采用蒸发溶剂的方法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com