

| 方案 | 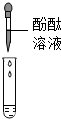 | 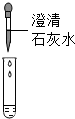 |
| 现象 | 溶液变红 | 产生白色沉淀 |
| 结论 | 清液中有氢氧化钠 | 清液中有碳酸钠 |
分析 【提出问题及猜想】
氢氧化钠可能没有变质,也可能已全部变质,也可能部分变质;
【实验探究】
化学反应前后,元素的种类不变,原子的种类、总个数不变;
显碱性的溶液能使酚酞试液变红色;
碳酸钠能和氢氧化钙反应生成白色沉淀碳酸钙和氢氧化钠;
碳酸钠能和氯化钡反应生成白色沉淀碳酸钡和氯化钠;
氯化钙和碳酸钠反应生成碳酸钙沉淀和氯化钠.
解答 解:【提出问题及猜想】
①猜想Ⅰ:没有变质 猜想Ⅱ:已全部变质 猜想Ⅲ:部分变质.
故填:部分变质.
【实验探究】
(1)按如图实验,发现澄清石灰水变浑浊,说明固体酒精燃烧生成了二氧化碳,进一步说明固体酒精中含有碳元素,即酒精中含有碳元素,此结论合理.
故填:合理.
(2)向清液中加入澄清石灰水时,如果产生白色沉淀,说明清液中含有碳酸钠;
因碳酸钠溶液呈碱性也能使酚酞溶液变红,因此应该除去碳酸钠,方法是:另取烧杯中上层清液,加足量氯化钡溶液,充分反应后再滴加酚酞溶液,酚酞溶液变红,说明清液中含有氢氧化钠.
故填:白色沉淀;氯化钡.
【实验结论】
经讨论一致认为猜想Ⅲ成立,此时上层清液中所含的溶质有酒精、碳酸钠、氢氧化钠和氯化钙与碳酸钠反应生成的氯化钠.
故填:酒精、氯化钠、碳酸钠和氢氧化钠.
【反思交流】
乙组实验中加足量该溶液的目的是除去碳酸钠,以免对检验氢氧化钠产生影响.
故填:除去碳酸钠.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


科目:初中化学 来源: 题型:选择题
| A. | X Y Z | B. | Z Y X | C. | Y Z X | D. | X Z Y |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 铅锑合金由于熔点低,用来做保险丝 | |
| B. | 用柠檬酸、果汁、白糖、水、小苏打等制汽水 | |
| C. | 用灼烧的方法鉴别棉布和丝绸 | |
| D. | 用活性炭可将硬水进行软化 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度 (g) | NaOH | 31 | 91 | 111 | 129 | 313 | 336 |
| Ca(OH)2 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 | |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com