
| A、Zn | B、Cu | C、Mg | D、Al |
| 56 |
| 5.6g |
| 2 |
| x |
| 65 |
| 5.6g |
| 2 |
| y |
| 24 |
| 5.6g |
| 2 |
| z |
| 54 |
| 5.6g |
| 6 |
| m |


科目:初中化学 来源: 题型:
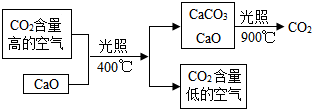 碳元素是组成许多物质的基本元素.
碳元素是组成许多物质的基本元素.查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
| A、农业上合理使用农药和化肥有利于水资源的保护 |
| B、自来水中只含有水分子,不含有其他粒子 |
| C、我国可利用的淡水资源十分丰富 |
| D、水体有自净能力,生活污水可直接排放 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、35% | B、35.7% |
| C、34.3% | D、17.15% |
查看答案和解析>>
科目:初中化学 来源: 题型:
| R | O2 | CO2 | H2O | |
| 反应前质量(/g) | 51 | 96 | 0 | 0 |
| 反应后质量(/g) | x | 0 | 88 | 54 |
| A、x值为5 |
| B、R物质中碳、氢质量比为4:1 |
| C、R物质含有碳、氢、氧三种元素 |
| D、反应生成二氧化碳和水的分子个数比为3:2 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、25% | B、81.5% |
| C、50% | D、62.5% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com