
分析 A、根据硫磺在空气中燃烧的现象进行分析判断.
B、根据蜡烛在空气中燃烧的现象进行分析判断.
C、根据木炭在氧气中燃烧的现象进行分析判断.
D、根据铁丝在氧气中燃烧的现象进行分析判断.
解答 解:A、硫磺在空气中燃烧,发出淡蓝色火焰,放出热量,生成刺激性气味的气体,故选项说法错误.
B、蜡烛在空气中燃烧产生黑烟,故选项说法错误.
C、木炭在氧气中燃烧,发出白光,放出热量,故选项说法正确.
D、铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体.
故选C;补充:铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体.
点评 本题难度不大,掌握常见物质燃烧的现象即可正确解答;在描述物质燃烧的现象时,需要注意光和火焰、烟和雾的区别.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:解答题
 取甲、乙两支洁净的试管,分别注入3mL淀粉溶液,然后在甲试管中注入2mL新鲜的小麦淀粉酶滤液,在乙试管中注入2mL清水.振荡两支试管,将其下半部浸在37℃左右的温水中约5min,然后同时取出两试管,分别滴入1滴碘液.如图所示,请回答:
取甲、乙两支洁净的试管,分别注入3mL淀粉溶液,然后在甲试管中注入2mL新鲜的小麦淀粉酶滤液,在乙试管中注入2mL清水.振荡两支试管,将其下半部浸在37℃左右的温水中约5min,然后同时取出两试管,分别滴入1滴碘液.如图所示,请回答:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 反应前物质的质量/g | 反应后物质的质量/g | |
| Cu-Zn合金 | 稀硫酸 | 滤液 |
| 4.0 | 10 | 11.26 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 阴离子 阳离子 | OH- | CO32- | HCO3- |
| Ca2+ | 微溶 | 不溶 | 可溶 |
| Mg2+ | 不溶 | 微溶 | 可溶 |
| 实验步骤 | 实验现象 | 结论 |
| 在少量研碎的水垢中,加入适量的蒸馏水充分搅拌,过滤,在滤液里加入Na2CO3溶液. | 无白色沉淀 | 水垢中无Ca(OH)2 |
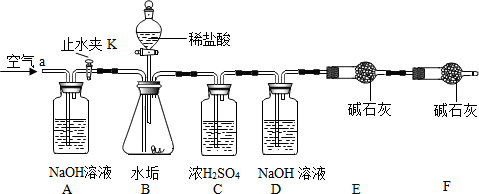
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com