
(7分) 工业上常用稀盐酸处理铁制品表面的铁锈,据此请回答下列问题:
(1)除去铁锈的过程中还可以看到的一项实验现象是______________________________;
(2)如果稀盐酸用量太多就会看到有气泡产生,用化学方程式说明原因:
____________________________________________;
(3)工业上用了30千克溶质质量分数为7.3%的稀盐酸,与某铁制品表面的铁锈恰好完全反应,求反应后溶液的质量。(计算结果精确到小数点后一位)
(1)铁锈消失,溶液变为黄色
(2) Fe+2HCl= FeCl2+H2↑
(3)所得溶液的质量是31.6kg。
解析试题分析:(1)铁锈的成分为氧化铁,与盐酸反应会生成可溶于水的氯化铁,所以可观察到:铁锈消失,溶液变为黄色;
(2)如果稀盐酸用量太多,则与表面的氧化铁反应之后,还可与未生锈的铁反应生成氢气,会看到有气泡产生。化学方程式为:Fe+2HCl= FeCl2+H2↑;
(3)根据题意可知,已知量为盐酸的质量;未知量为反应后溶液的质量。
解题思路:反应后的溶液为盐酸与氧化铁反应所得,所以反应后的溶液的质量为加入的盐酸的质量与反应的氧化铁的质量的和。可根据化学方程式中二者间的质量关系,求出氧化铁的质量,再进一步求出未知量。具体过程如下:
解:设氧化铁的质量为x 30kg×7.3%=2.19kg
Fe2O3 + 6HCl 2FeCl3+3H2O
160 219
x 2.19kg
160:219=x:2.19kg
x=1.6kg
所得溶液的质量为:30kg+1.6kg=31.6kg
答:所得溶液的质量是31.6kg。
考点:酸的化学性质、综合计算


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:初中化学 来源: 题型:计算题
(5分) 55.7 g碳酸钠溶液恰好与36.5 g某盐酸溶液完全反应,测得反应后溶液的质量为90 g,求:
(1)生成了多少克二氧化碳?
(2)反应后所得溶液的溶质质量分数是多少?
(3)所用稀盐酸中溶质的质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(7分)经科学检测,蛋壳中含碳酸钙83—85%,蛋白质15—17%,并含有多种微量元素锌、铜、铁、硒等。小波同学为了亲自检测蛋壳中的某些成分以及含量,进行了实验探究。请回答相关问题:
(1)关于蛋壳的叙述中,你认为错误的一项是( )
| A.含钙、锌、铜、铁、硒等微量元素 |
| B.是由无机物和有机物等组成的混合物 |
| C.蛋壳焙干研粉,胃病患者服用,有止痛和治疗胃酸过多的效果 |
| D.可以加工成乳酸钙、葡萄糖酸钙等产品,变废为宝 |

查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(3分)电动自行车、小汽车等交通工具中都有为其提供电能的铅蓄电池(又称“电瓶”),它的优点是可以充电循环使用,电瓶内发生的化学反应是:
PbO2(固)+ 2H2SO4 + Pb = 2PbSO4↓+ 2H2O
某电瓶中装有36%的稀硫酸1200 g,电瓶工作时有310.5 g的铅参加反应。试计算:
(1)原稀硫酸中所含溶质的质量是 g。
(2)电瓶工作时消耗硫酸的质量。
(3)反应后硫酸溶液中溶质的质量分数。(最后结果精确到0.01%)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
草木灰是一种农家肥,它的主要成分是碳酸钾,还有硫酸钾,氯化钾等。化学兴趣小组为测定某草木灰样品中的有效成分,取50g草木灰于烧杯中,不断滴入硫酸溶液,当滴入30g硫酸溶液时,不再有气泡产生,此时烧杯中的残余混合物的质量为77.8g。(假设草木灰的其他成分不含钾元素且不与酸反应)
请计算回答:
(1)草木灰的主要成分所属的物质类别为____________(填“酸、碱或盐”)。
(2)如图表示反应过程中放出的气体质量与加入硫酸溶液的关系曲线,请求出图中纵坐标上a点数值:a=________________g;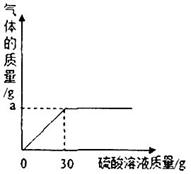
(3)计算草木灰样品中碳酸钾的质量分数。(要求写出计算过程)
(4)通过其他实验,测得该50g草木灰中还含的硫酸钾质量为8.7g,氯化钾的质量为1.49g,则该50g草木灰样品中钾元素的质量为__________g。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
小王同学在厨房中发现一袋白色粉末状的食用物,包装袋上表示的化学成分字迹不清,于是他带到实验室探究其成分。(填空没空1分,计算4分,计10分)
【猜想与假设】猜想1.可能是淀粉 猜想2.可能是纯碱
猜想3.可能是食盐 猜想4.可能是 (俗称小苏打)
【查阅资料】小苏打溶液显碱性,与氯化钡溶液不反应
【实验探究】
| 实验操作 | 实验现象 | 实验结论 |
| (1)取样,溶于适量的水 | 形成无色溶液 | 猜想 不成立 |
| (2)取少量品尝 | 有苦涩味 | 不是 |
| (3)向(1)的溶液中滴加酚酞试液 | 溶液变红 | 是纯碱 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(3分)将Na2CO3和NaCl固体混合物32.9g放入烧杯中,此时总质量为202.9g,加入326.9g盐酸,恰好完全反应,待没有气泡逸出后再次称量,总质量为521.0g。计算所得溶液中溶质的质量分数(CO2的溶解忽略不计)。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
街头上有许多便宜的“黄金”饰品出售,实际上它们不是黄金,而是铜锌合金,因其具有较好的机械性能和光泽度,所以常被做成饰品.现取30g该合金样品,投入到196g某浓度的稀硫酸中,恰好完全反应后,剩余的溶液和残余固体总质量为225.6g.请计算:
(1)产生氢气的质量为 g
(2)剩余溶液中溶质的质量分数是多少?(结果保留到1%).
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
重铬酸钾(K2Cr2O7Mr=294,铬元素为+6价,Mr表示相对分子质量)是一种重要的化工原料,在皮革工业、有机反应中都有广泛应用.但+6价格有很强的毒性易污染环境,使用后,须用绿矾,(FeSO4?7H2O,Mr=278)将其变成毒性+3价格才能做后续处理.反应原理是:6FeSO4?7H2O+K2Cr2O7+7H2SO4═3Fe2(SO4)3+Cr2(SO4)3+K2SO4+49H2O现有1.0吨重铬酸钾需要处理,计算需绿矾多少吨?(写出计算过程,结果精确到小数点后1位)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com