
【题目】钛和钛合金被认为是21世纪重要的金属材料。钛合金与人体具有很好的“相容性”,可用于制造人造骨骼。工业上以钛铁矿(主要成分为钛酸亚铁,FeTiO3)为原料生产钛,其工业流程示意图如下:
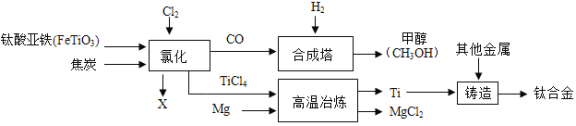
请回答:(1)钛合金属于_______(选填“混合物”、“纯净物”)。
(2)钛酸亚铁FeTiO4中钛的化合价为______价。
(3)以CO和H2在合成塔中生产甲醇(CH3OH)属于化合反应,其化学方程式为________________。
(4)经高温冶炼得到金属钛,则参加反应的镁与生成钛的质量比为_________。
(5)氯化过程中主要发生的反应为2FeTiO3+6C+7Cl2![]() 2TiCl4+2X+6CO,则X的化学式为______。
2TiCl4+2X+6CO,则X的化学式为______。
【答案】混合物 +4CO+2H2=CH3OH1:1FeCl3
【解析】
(1)由两种或两种以上物质组成的物质叫混合物;由一种物质组成的物质叫纯净物;(2)化合物中元素的化合价的代数和为零,设钛酸亚铁FeTiO4中钛的化合价为x,亚铁指+2价的铁元素,则x+(+2)+(-2)×4=0, x=+4;(3)由两种或两种以上物质生成一种物质的反应叫化合反应;以CO和H2在合成塔中生产甲醇(CH3OH)属于化合反应,化学方程式为CO+2H2=CH3OH;(4)经高温冶炼得到金属钛,TiCl4+2Mg═Ti+2MgCl2则参加反应的镁与生成钛的质量比为2×24:48=1:1;(5)据质量守恒定律可知,化学反应前后原子的种类、个数不变,反应前有6个氧原子、6个碳原子、 14个氯原子、2个铁原子,反应后有有6个氧原子、6个碳原子、 14个氯原子、2个铁原子,所以一个X的分子中有3个氯原子、1个铁原子;X的化学式为FeCl3。


科目:初中化学 来源: 题型:
【题目】向MgO和CuO的混合物12g中加入稀硫酸至恰好溶解,再向所得溶液中加入NaOH溶液至恰好沉淀完全,生成Mg(OH)2和Cu(OH)2沉淀的总质量为15.6g,则参加反应的NaOH的质量为(已知MgO+H2SO4=MgSO4+H2O;MgSO4+2NaOH=Mg(OH)2↓+Na2SO4)
A. 3.6gB. 8.0 gC. 18.0gD. 16.0g
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】锂在元素周期表中的信息如图甲所示,图乙表示某粒子的结构示意图。下列说法正确的是( )
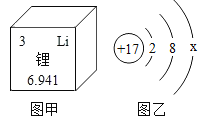
A. 由图甲可知锂的相对原子质量为6.941 g
B. 锂原子核外有3个电子,金属锂能与O2反应生成Li2O3
C. x=8时,图乙表示氯原子的结构示意图
D. x=7时,图乙所示原子容易得到一个电子形成Cl﹣
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某氯化钙样品中可能混有氯化铁、氯化镁、氯化钠、碳酸钠中的一种或几种物质.取该样品11.1g溶于适量水中,得到澄清的无色溶液,然后向其中加入足量的硝酸银溶液,得到29.7g白色沉淀,则该样品组分的下列推断中,正确的是
A. 既无氯化铁,也无碳酸钠B. 只有氯化镁,没有氯化钠
C. 肯定有氯化镁,可能有氯化钠D. 肯定有氯化镁,也肯定有氯化钠
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学与生活、科技、环境密切相关。
(1)化学与生活
①喝了汽水以后,常常会打嗝,说明气体溶解度与_________________有关。
②炒菜时油锅中的油不慎着火,可采取的灭火方法是_______________或放入较多蔬菜。
(2)化学与科技
交警通过吹气法检查司机“酒驾”的化学原理是:橙色K2Cr2O7的酸性溶液遇乙醇迅速反应生成硫酸铬,其溶液含铬离子(Cr3+)而为蓝绿色。下列相关说法正确的是_________。
A.酒中含有的酒精属于有机物
B.K2Cr2O7属于氧化物
C.交警能闻到酒味是因为分子之间有空隙
D.硫酸铬的化学式为Cr2(SO4)3
(3)化学与环境
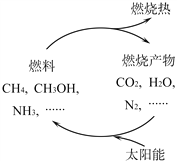
日益严峻的能源危机促进了可再生能源的研究。有专家提出:如果能够利用太阳能使燃料燃烧产物,如CO2、H2O、N2等重新组合(如下图),可以节约燃料,缓解能源危机。
①在此构想的物质循环中太阳能最终转化为___________能。
②试根据图示写出氨气作为燃料燃烧的化学方程式___________。
③___________g甲醇(CH3OH)中碳元素质量与16g甲烷中碳元素质量相等。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学课堂围绕“酸碱中和反应”在老师引导下开展探究活动。以下是教学片段,请你参与学习并帮助填写空格(包括表中空格)
[演示实验]将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中。
该反应的化学方程式为____________________。
[提出问题]实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
[假设猜想]针对疑问,大家纷纷提出猜想。甲组同学的猜想如下:
猜想一:只有Na2SO4
猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4、H2SO4和NaOH
猜想四:________________________。
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的,不合理的猜想是________。
[实验探究](1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有____________。
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用老师提供的酚酞溶液、铁片、Na2CO3溶液,进行如下三个方案进行探究。
实验方案 | ①加入酚酞溶液 | ②加入铁片 | ③滴入溶液 |
实验操作 |
|
|
|
实验现象 | 溶液不变色 | _________ | 产生气泡 |
实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
[得出结论]通过探究,全班同学一致确定猜想二是正确的。
[评价反思](1)老师对同学们能用多种方法进行探究给予肯定。同时指出实验方案①不能得出正确结论,原因是_______________。
(2)请你再选择一种以上三种试剂属不同类别的试剂进行验证,写出实验步骤和现象_______________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据图回答:
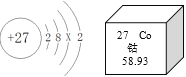
(1)钴原子的核电荷数是_____,X=_____。
(2)钴在化学反应中容易_____(填“得到”或“失去”)电子,相对原子质量是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】李小龙,祖籍广东佛山市顺德区均安镇,不仅是享誉海内外的功夫巨星也是一位武术哲学家。其创立的截拳道,体现了融合生成的方法论思想。在化学学习过程中,老师设计了如图的“功夫小子”游戏,图中A B C D E F G H分别是氢气、稀盐酸、铁粉、氧化铜、碳酸钡、二氧化碳、澄清石灰水、纯碱溶液中的一种,游戏规则:①要求相连的两种物质能发生化学反应,且E与F不反应,G与H不反应;②B与D的物质类别相同;③物质不能重复。请你参加完成游戏,并回答下列问题:
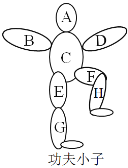
(1)找出图中物质的化学式:A:_____;D:_____。
(2)已知B能与F反应,该反应的化学方程式为_____,该反应常用来_____。
(3)E→H的反应基本类型与E和G的反应类型相同,写出E→H的化学方程式:_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】过氧化镁(MgO2)是一种镁精细化工产品。在医疗上可用来治疗消化不良、胃酸过多等疾病。在环境保护方面,过氧化镁可用来处理地下水污染的土壤。还可以用于牙膏,对牙齿有漂白和防过敏的作用。某化学兴趣小组对过氧化镁的性质和制备等进行了以下研究。
一.过氧化镁的性质
(1)过氧化镁(其中氧元素的化合价为____)是一种白色的粉末,其外观与物理性质与氧化镁相似。化学性质不够稳定,不溶于水,但逐渐的被分解放出氧气。
过氧化镁有强氧化性,常温下比较稳定,但是加热时会分解生成氧气和氧化镁。请下出该反应的化学方程式________。
(2)过氧化镁易溶于稀盐酸,发生反应:MgO2+2HCl=MgCl2+H2O2同时温度升高,说明该反应热量__________(填“放出”或“吸收”)。
二.过氧化镁的制备
下图是利用碱式碳酸镁(Mg2(OH)2CO3)和30%的过氧化氢溶液来制取过氧化镁。
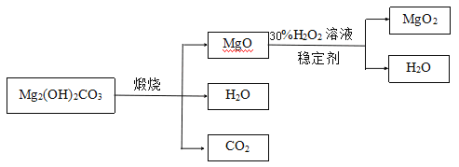
(资料)①碱式碳酸镁与碳酸镁有相似的化学性质,能与稀盐酸反应产生二氧化碳②氧化镁与过氧化氢反应放出大量的热
(3)检测煅烧过程碱式碳酸镁完全分解的方法是_________(写出具体的操作和现象);上述生产过程加入稳定的剂的作用是________。
(4)用上述碱式碳酸镁在550、600、650及700℃下煅烧一定的时间生成氧化镁。用上述条件制备的氧化镁分别与30%双氧水反应合成过氧化镁产率(见图1和图2)。
碱式碳酸镁煅烧的温度适宜控制在________℃,煅烧的时间适宜控制在______h。
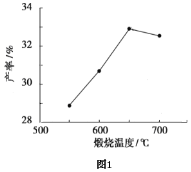
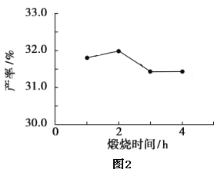
(5)结果在适宜的温度和时间下,碱式碳酸镁能完全分解,并且得到的氧化镁颗粒表面积最大,能与30%过氧化氢充分反应,所以产率高。推测700℃时,产率明显降低的可能的原因____。
三.过氧化镁产品纯度检测
在生产过程中,过氧化镁中常常含有少量的氧化镁杂质(其他杂质不考虑),以下是该小组进行纯度检测的实验装置和实验步骤。

①检查装置气密性,装入药品(样品质量为0.7g),调节刻度管使左右两边液面相平,刻度管度数为10.0mL。
②打开分液漏斗开关,待瓶中无气泡产生时,关闭开关。
③再次调节刻度管使左右两边液面相平,刻度管度数为122mL。
(6)稀盐酸中放入的少量硫酸铜溶液目的是__________。
(7)根据上面实验数据计算样品中过氧化镁的质量分数__________(写出具体的计算过程,实验条件下O2密度为1.429g/L)。
(8)该小组同学所测得质量分数比实际结果偏大,你觉得可能的原因是(_______)
A 生成的氧气有少量溶于水 B 未等装置冷却到室温就开始读数
C 杂质与盐酸反应能产生少量的气体 D 滴入的稀盐酸占了一部分气体的体积
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com