
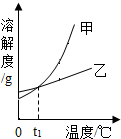
 NH4Cl和KNO3的溶解度表及溶解度曲线如下.下列说法正确的是( )
NH4Cl和KNO3的溶解度表及溶解度曲线如下.下列说法正确的是( )| 温度/℃ | 20 | 30 | 50 | 60 | |
| 溶解度S/g | NH4Cl | 37.2 | 41.4 | 50.4 | 55.2 |
| KNO3 | 31.6 | 45.3 | 85.5 | 110 | |
| A. | 甲表示NH4Cl溶解度曲线 | |
| B. | t1应介于20℃~30℃ | |
| C. | 40℃时,给饱和溶液蒸发相同质量的水,析出晶体的质量:KNO3>NH4Cl | |
| D. | 50℃时,在50g水中分别加入30gKNO3、30gNH4Cl,得到的溶液质量分数都是37.3% |
分析 A、硝酸钾的溶解度受温度影响更大,所以甲是硝酸钾的溶解度曲线;
B、据表格分析可知:硝酸钾和氯化铵的溶解度相等的温度在20℃~30℃之间;
C、40℃时硝酸钾的溶解度大于氯化铵的溶解度,据此分析解答;
D、据该温度下两物质的溶解度和溶质质量分数计算方法解答.
解答 解:A、由题目的信息可知:甲、乙两种固体物质的溶解度,都是随温度升高而增大,而乙的溶解度随温度的升高变化不大,甲的变化大,因此甲是硝酸钾,故错误;
B、由表中数据分析可知,KNO3和NH4Cl在某一温度时具有相同的溶解度,该温度应在20℃~30℃之间,正确;
C、由B可知,二者溶解度相等在20℃~30℃之间,由溶解度曲线可知:在交点温度后硝酸钾的溶解度始终大于氯化铵的溶解度,所以40℃时硝酸钾的溶解度大于氯化铵的溶解度,即等质量的水中最多溶解的硝酸钾的质量大于氯化铵,故40℃时,给饱和溶液蒸发相同质量的水,析出晶体的质量:KNO3>NH4Cl,正确;
D、由表中数据分析可知,50℃时硝酸钾的溶解度是85.5g,氯化铵的溶解度是50.4g,所以在50g水中分别加入30gKNO3可完全溶解,加入30gNH4Cl不能完全溶解,最多溶解25.2g,得到的溶液质量分数一定不相等,故错误;
故选:BC.
点评 本题主要考查了学生对溶解度概念的理解、溶解度曲线的应用等知识,能较好考查学生分析图表数据、结合溶解度曲线解答问题的能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:选择题
| A. | 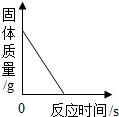 加热一定量高锰酸钾固体制取氧气 | |
| B. | 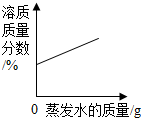 在恒温的条件下,将足量的氯化钠饱和溶液蒸发适量的水分 | |
| C. | 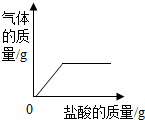 向露置在空气中部分变质的氢氧化钠溶液中逐滴加入稀盐酸 | |
| D. | 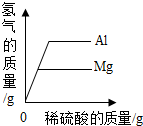 等质量的铝和镁,分别与足量、等溶质质量分数的稀硫酸反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 钠及其化合物是中学化学学习和研究的重要内容.
钠及其化合物是中学化学学习和研究的重要内容.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
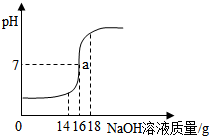 小丽在实验室进行酸碱中和实验,她将未知浓度的NaOH溶液逐滴加入到质量为20g浓度为14.6%的稀盐酸中,边加边搅拌,随着NaOH溶液的加入,溶液pH的变化如图所示.请回答:
小丽在实验室进行酸碱中和实验,她将未知浓度的NaOH溶液逐滴加入到质量为20g浓度为14.6%的稀盐酸中,边加边搅拌,随着NaOH溶液的加入,溶液pH的变化如图所示.请回答:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 反应①中的H2被还原 | B. | 反应②Cl2中的“Cl”得到电子 | ||
| C. | 反应②中X为TiCl4 | D. | 反应③说明Mg的金属活动性比Ti强 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com