
次数 加入锌片的质量 稀硫酸 产生H2质量
1 6.5g 100g 0.2g
2 13g 100g
3 19.5g 100g 0.6g
4 26g 100g 0.8g
5 32.5g 100g
6 39g 100g 0.8g
(1)第二、五次产生的氢气质量是多少?
(2)35g锌片与100g这种稀硫酸充分反应后,所得溶液的溶质质量分数为多少?
(3)稀硫酸的溶质质量分数为多少?
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源:化学教研室 题型:038
|
次数 |
加入锌片的质量 |
稀硫酸 |
产生H2质量 |
|
1 |
6.5 g |
100 g |
0.2 g |
|
2 |
13 g |
100 g |
|
|
3 |
19.5 g |
100 g |
0.6 g |
|
4 |
26 g |
100 g |
0.8 g |
|
5 |
32.5 g |
100 g |
|
|
6 |
39 g |
100 g |
0.8 g |
(1)第二、五次产生的氢气质量是多少?
(2)35 g锌片与100 g这种稀硫酸充分反应后,所得溶液的溶质质量分数为多少?
(3)稀硫酸的溶质质量分数为多少?
查看答案和解析>>
科目:初中化学 来源: 题型:038
某同学用
1g的铁屑、锌粒、镁片与足量稀硫酸反应制取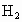 ,完全反应后,所需时间与当地金属价格见表.你认为实验室一般不选用铁屑、镁片与酸反应制氢气的主要原因是什么?
,完全反应后,所需时间与当地金属价格见表.你认为实验室一般不选用铁屑、镁片与酸反应制氢气的主要原因是什么?

查看答案和解析>>
科目:初中化学 来源:化学教研室 题型:043
某同学用
1g的铁屑、锌粒、镁片与足量稀硫酸反应制取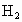 ,完全反应后,所需时间与当地金属价格见表.你认为实验室一般不选用铁屑、镁片与酸反应制氢气的主要原因是什么?
,完全反应后,所需时间与当地金属价格见表.你认为实验室一般不选用铁屑、镁片与酸反应制氢气的主要原因是什么?

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com