
科目:初中化学 来源: 题型:填空题
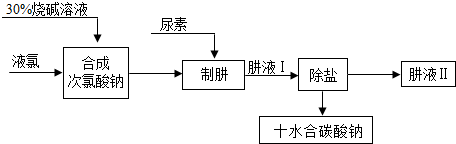
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验操作 | 实验现象 | 实验结论 |
| 取一定量的该漂白液加入到烧杯中,再放入有色布条 | 一段时间后,有色布条没有变化 | 该漂白液已完全失效 |
| 实验操作及实验现象 | 实验结论 |
| 取少量该漂白液于试管中,加入过量的稀盐酸.观察到有气泡产生 | 猜想①不合理 |
| 取一定量的漂白液于试管中,加入过量的CaCl2溶液使Na2CO3完全反应,静置后向上层清液中滴加酚酞溶液,无明显变化 | 猜想③不合理,②合理 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
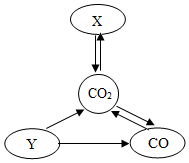 如图可用来表示C、CO、CO2、CaCO3四种物质间的相互转化关系,分析回答问题
如图可用来表示C、CO、CO2、CaCO3四种物质间的相互转化关系,分析回答问题查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
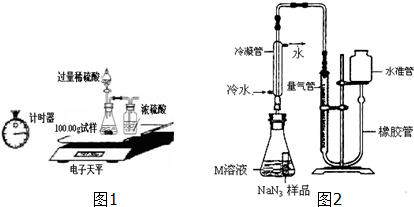
| 称量项目 | 称量时间 | 质量(g) |
| 试样 | 100.00 | |
| 装置+稀硫酸质量 | 241.20 | |
| 装置+稀硫酸质量+试样 | 反应开始后15秒 | 339.20 |
| 装置+稀硫酸质量+试样 | 反应开始后35秒 | 339.00 |
| 装置+稀硫酸质量+试样 | 反应开始后55秒 | 339.00 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com