
| A. | CH4 | B. | C2H6O | C. | C2H4 | D. | C2H2 |
分析 根据题意,某物质在空气中完全燃烧生成CO2和H2O的质量比为11:9,由质量守恒定律,反应前后元素种类不变,则某物质中一定含有碳元素和氢元素,可能含有氧元素;由生成二氧化碳和水的质量比计算出碳元素和氢元素的质量比,进而计算出该物质中碳原子和氢原子的个数比,结合化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析判断.
解答 解:某物质在空气中完全燃烧生成CO2和H2O的质量比为11:9,由质量守恒定律,反应前后元素种类不变,则某物质中一定含有碳元素和氢元素,可能含有氧元素;生成物中碳元素和氢元素的质量比为(11×$\frac{12}{44}$100%):(9×$\frac{1×2}{18}$×100%)=3:1;则该物质中碳原子和氢原子的个数比为$\frac{3}{12}:\frac{1}{1}$=1:4,观察4个选项,A选项符合要求.
故选:A.
点评 本题难度稍大,主要考查了质量守恒定律、化学式的计算,解题的关键是根据质量守恒定律确定确定物质的元素组成.


科目:初中化学 来源: 题型:解答题
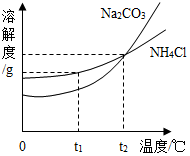 南海是我国的固有领海,南海蕴藏着丰富的海洋资源.
南海是我国的固有领海,南海蕴藏着丰富的海洋资源.查看答案和解析>>
科目:初中化学 来源: 题型:推断题
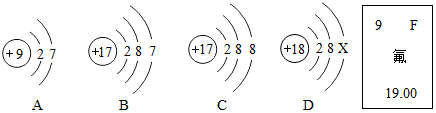
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
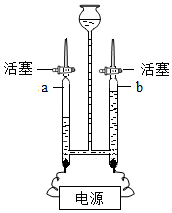 如图为探究水的组成的实验装置,请回答下列问题.
如图为探究水的组成的实验装置,请回答下列问题.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 分子数比为1:1的H2和Cl2 | B. | 分子数比为1:1的CO和O2 | ||
| C. | 质量比为1:5的CH4和O2 | D. | 质量比为1:3的C和O2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
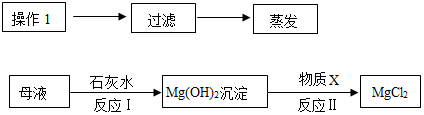
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com