
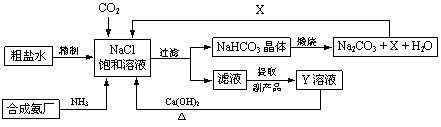
我国制碱工业的先驱侯德榜将制碱与制氨结合起来的联合制碱法,为纯碱和氮肥工业技术的发展做出了杰出的贡献。其生产工艺流程示意图如下:
 |
| 部分物质溶解性(室温) | |||
| OH- | SO42- | CO32- | |
| Mg2+ | 不 | 溶 | 微 |
| Ca2+ | 微 | 微 | 不 |
| Ba2+ | 溶 | 不 | 不 |
⑴粗盐水中主要含有Ca2+、Mg2+、SO42-等杂质离子,工业上常用加入稍过量的NaOH溶液、Na2CO3溶液、BaCl2溶液及适量的盐酸等除杂、精制。则加入试剂合理的顺序为 、盐酸(只写一种)。加盐酸的作用是(用化学方程式表示) 、 。
⑵制碱原理为:NaCl + CO2 + NH3 + H2O = NaHCO3↓+ NH4Cl,该反应原理可看作是由①CO2 + NH3 + H2O = NH4HCO3和②NaCl + NH4HCO3 = NaHCO3↓+ NH4Cl两个反应加合而成,则的反应类型为 。
⑶X的化学式为 。
⑷Y是滤液中最主要成分,Y与Ca(OH)2反应的产物之一可用于循环使用,该产物的名称为 ,Y的化学式为 ,写出Y的一种用途 。
解:(1)加入碳酸钠的作用有两个:一个是除去溶液中的Ca2+、另一个是除去过量的氯化钡,所以加入的碳酸钠必须排在氯化钡的后面,所以顺序是NaOH、BaCl2、Na2CO3;加入盐酸的目的是除去过量的氢氧化钠和过量的碳酸钠,盐酸与氢氧化钠反应的反应物是盐酸和氢氧化钠,生成物是氯化钠和水;盐酸与碳酸钠反应的反应物是盐酸和碳酸钠,生成物是氯化钠、水、二氧化碳;用观察法配平即可;
(2)根据CO2+NH3+H2O=NH4HCO3可以将NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl这一反应物中的CO2、NH3、H2O用NH4HCO3代替,所以产物是通过相互交换成分得到的,属于复分解反应;
(3)碳酸氢钠煅烧生成碳酸钠、水、二氧化碳,所以X是二氧化碳;
(4)根据NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl,由图示可知过滤后的产物是碳酸氢钠和滤液,所以结合前面的方程式可知滤液是氯化铵溶液,所以Y是氯化铵;Y与Ca(OH)2反应的产物之一可用于循环使用,又因为氢氧化钙与氯化铵反应生成氯化钙、氨气和水,且氨气在前面已经用过,所以循环使用的物质是氨气;氯化铵可以用来做氮肥.
故答案为:(1)NaOH、BaCl2、Na2CO3;NaOH+HCl═NaCl+H2O;Na2CO3+2HCl═2NaCl+H2O+CO2↑;(2)复分解反应;(3)CO2;(4)氨气;NH4Cl;制取氮肥.


科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:初中化学 来源: 题型:

| 部分物质溶解性(室温) | |||
| OH- | SO42- | CO32- | |
| Mg2+ | 不 | 溶 | 微 |
| Ca2+ | 微 | 微 | 不 |
| Ba2+ | 溶 | 不 | 不 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com