
分析 (1)铁锈的主要成分是氧化铁,把生锈的铁钉放到足量的稀盐酸中,表面的铁锈先与盐酸反应,当铁锈完全反应完后,铁继续与盐酸反应,据此写出反应的化学方程式即可.
(2)根据金属活动性顺序表可知,金属的活动性是:锌>铁>氢>铜.将一定量的锌粉放入稀盐酸、氯化亚铁、氯化铜的混合溶液中,锌首先与氯化铜反应生成铜和氯化锌,当氯化铜反应完成后,锌再与稀盐酸反应生成氯化锌和氢气,然后与氯化亚铁反应生成铁和氯化锌,在滤出的固体中滴加稀盐酸,有气泡产生,说明固体中含有的金属中有能与盐酸反应的金属,即排在氢前面的金属,再进一步进行分析.
解答 解:(1)铁锈的主要成分是氧化铁(Fe2O3),将生锈的铁钉放入稀盐酸中,先是表面的铁锈的主要成分氧化铁与盐酸反应生成氯化铁与水,反应的化学方程式为:Fe2O3+6HCl═2FeCl3+3H2O;.
(2)由金属活动性顺序表可知,金属的活动性是:锌>铁>氢>铜.将一定量的锌粉放入稀盐酸、氯化亚铁、氯化铜的混合溶液中,锌首先与氯化铜反应生成铜和氯化锌,当氯化铜反应完成后,锌再与稀盐酸反应生成氯化锌和氢气,然后与氯化亚铁反应生成铁和氯化锌,在滤出的固体中滴加稀盐酸,有气泡产生,说明固体中含有的金属中有能与盐酸反应的金属,该金属可能是铁或铁、锌的混合物,由题意,不能确定锌是否有剩余,但滤渣中一定含有固体铜和铁;溶液中的氯化铜、盐酸已经被锌完全反应,则滤液中一定不含的物质是HCl和CuCl2.
故答案为:(1)Fe2O3+6HCl=2FeCl3+3H2O;(2)Fe和Cu;HCl和CuCl2.
点评 本题难度不大,掌握酸的化学性质、金属活动性顺序应用是正确解答本题的关键.


科目:初中化学 来源: 题型:解答题
 实验探究题.南宋诗人赵师秀有诗“黄梅时节家家雨,青草池塘处处蛙.有约不来过夜半,闲敲棋子落灯花.”诗中“灯花”是蜡烛不完全燃烧产生的炭附着在蜡烛烛芯上的现象.
实验探究题.南宋诗人赵师秀有诗“黄梅时节家家雨,青草池塘处处蛙.有约不来过夜半,闲敲棋子落灯花.”诗中“灯花”是蜡烛不完全燃烧产生的炭附着在蜡烛烛芯上的现象.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 铁丝在氧气中剧烈燃烧、火星四射、生成白色固体 | |
| B. | 红磷在空气中燃烧产生大量白雾 | |
| C. | 二氧化碳通入紫色石蕊试液中,溶液由紫色变为红色 | |
| D. | 一氧化碳高温还原氧化铁时,红色粉末逐渐变为银白色 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 事实 | 解释 | |
| A | 氯化钠溶液能导电 | 溶液中有自由移动的氯化钠分子 |
| B | 很多宝石具有绚丽多彩的颜色 | 宝石中含有某些金属离子 |
| C | 溶液之间的化学反应比固体之间化学反应快 | 参加反应的粒子在溶液中接触的机会比在固体中接触的机会多 |
| D | 硫酸铜溶液和硫酸亚铁溶液的颜色不同 | 两溶液中的阳离子不同 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 已知:白色Fe(OH)2很容易被空气中的氧气氧化为Fe(OH)3,Fe(0H)3为红褐色沉淀,用下面两种方法可以制得白色的Fe(OH)2沉淀.
已知:白色Fe(OH)2很容易被空气中的氧气氧化为Fe(OH)3,Fe(0H)3为红褐色沉淀,用下面两种方法可以制得白色的Fe(OH)2沉淀.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
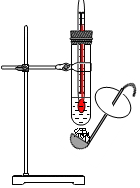 学习了脂肪、糖类和蛋白质在生物体内的作用的相关内容后,小应依据《科学》教材进行了如下实验:
学习了脂肪、糖类和蛋白质在生物体内的作用的相关内容后,小应依据《科学》教材进行了如下实验:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com