
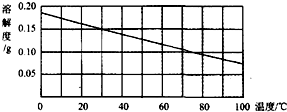
 如图是氢氧化钙的溶解度曲线图.现有60℃含100g水的澄清氢氧化钙饱和溶液(容器底部无固体)降温到10℃.下列说法正确的是( )
如图是氢氧化钙的溶解度曲线图.现有60℃含100g水的澄清氢氧化钙饱和溶液(容器底部无固体)降温到10℃.下列说法正确的是( )

 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:

查看答案和解析>>
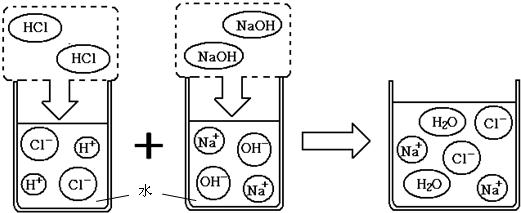
科目:初中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
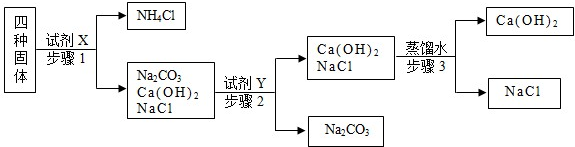
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
 我国有较长的海岸线,海洋资源十分丰富.
我国有较长的海岸线,海洋资源十分丰富.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com