
某化学兴趣小组对CO2是否支持常见金属的燃烧进行探究活动。
【活动一】探究CO2是否支持实验室常见金属镁的燃烧
实验①:将镁条用细砂纸打磨光亮,在酒精灯上点燃,再将燃着的镁条插入充满CO2的集气瓶,发现镁条仍燃烧。生成物除白色MgO外,还有一种黑色固体。
⑴、将镁条用细砂纸打磨光亮,是为了 。
⑵、镁在CO2中反应的化学方程式为 ,此反应的基本类型是 。
⑶、实验①的结论是 。由该结论可知 (写“能”或“不能”)用CO2灭火器扑灭活泼金属的火灾。
⑷、通过实验①你对燃烧条件的新认识是 。
【活动二】探究CO2是否支持生活中常见金属铁的燃烧,兴趣小组设计如下方案:(本题回答正确将奖励4分,但化学试卷总分不超过60分。)
方案①:将弯成螺旋状的细铁丝系上一支火柴,点燃火柴,待火柴快燃尽时,插入装有CO2的集气瓶中,观察铁丝能否被引燃。
方案②:将弯成螺旋状的细铁丝系上一段镁带,点燃镁带,待镁带快燃尽时,插入装有CO2的集气瓶中,观察铁丝能否被引燃。
实验评价:你认为方案 (填①或②)更为科学。
理由是:
。
【活动一】
(1)除去镁条表面的氧化膜
(2)2Mg+CO2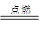 2MgO+C 置换反应
2MgO+C 置换反应
(3)CO2支持镁的燃烧(镁在CO2中可以燃烧); 不能
(4)物质燃烧不一定有O2参加反应
【活动二】
② CO2不支持火柴燃烧,燃着的火柴放入CO2中立即熄灭,不能对铁丝加热;CO2支持镁带燃烧,燃着的镁带放入装有CO2中能持续燃烧,能使铁丝充分受热。
【解析】
试题分析:【活动一】(1)将镁条用细砂纸打磨光亮,是为了除去镁条表面的氧化膜;(2)化学方程式为2Mg+CO2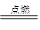 2MgO+C,反应类型为置换反应;(3)实验一的结论是CO2支持镁的燃烧,所以不能用二氧化碳灭火器来扑灭镁的火灾;(4)通过实验①可知物质燃烧不一定有O2参加反应;【活动二】方案②更科学,因为CO2不支持火柴燃烧,燃着的火柴放入CO2中立即熄灭,不能对铁丝加热;CO2支持镁带燃烧,燃着的镁带放入装有CO2中能持续燃烧,能使铁丝充分受热。
2MgO+C,反应类型为置换反应;(3)实验一的结论是CO2支持镁的燃烧,所以不能用二氧化碳灭火器来扑灭镁的火灾;(4)通过实验①可知物质燃烧不一定有O2参加反应;【活动二】方案②更科学,因为CO2不支持火柴燃烧,燃着的火柴放入CO2中立即熄灭,不能对铁丝加热;CO2支持镁带燃烧,燃着的镁带放入装有CO2中能持续燃烧,能使铁丝充分受热。
考点:探究二氧化碳是否支持常见金属燃烧
点评:此题考察知识点较为陌生,但仔细审题可知考察的思想和基本知识点都是中考要求的基本知识,此题有一定的难度,要多读提,多联系题干。


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:阅读理解


| 实验操作 | 实验现象 | 实验结论 | |
| ① | 在尖嘴处点燃气体, 在火焰上方罩一个 .干燥、洁净的烧杯 |
烧杯内壁 .有无色液滴 |
混合气体中含有氢气 . |
| ② | 在火焰上方罩一个涂 .有少量石灰水的烧杯 |
烧杯内澄清 .石灰水变浑浊 |
混合气体中含有一氧化碳 . |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

| ||
| ||
| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
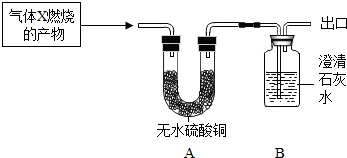
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

| ||
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com