
| 实验步骤 | 实验现象 | 实验结论 | |
| 实验一 | 有少量气泡 木条不复燃 |
常温下过氧化氢溶液分解速率很慢. | |
| 实验二 | 在装有过氧化氢溶液的试管中加入少量Al2O3,然后将带火星的木条伸入试管中 | 产生大量的气泡 木条复燃 |
| 实验步骤 | 实验现象 | 实验结论 | |
| 实验一 | 将带火星的木条伸入装有过氧化氢溶液的试管中 | ||
| 实验二 | Al2O3能加快过氧化氢的分解速率 |
| ||


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:初中化学 来源: 题型:阅读理解
| 实验步骤 | 实验现象 | 实验结论 |
| ① | 金属材料部分溶解,同时产生无色无味的气体. | |
| ②倒出实验①的溶液,再向剩余的金属固体中加入足量的盐酸,然后在加入足量氢氧化钠溶液 | 金属固体剩余物是镁 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
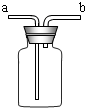
 下面是实验室制取氧气的装置图,根据装置图回答下列问题:
下面是实验室制取氧气的装置图,根据装置图回答下列问题:
| ||
| △ |
| ||
| △ |
| ||
| ||
| 实验步骤 | 实验现象 | 实验结论 | |
| 实验一 | 将带火星的木条伸入装有过氧化氢溶液的试管中 将带火星的木条伸入装有过氧化氢溶液的试管中 |
有少量气泡 木条不复燃 |
常温下过氧化氢溶液分解速率很慢. |
| 实验二 | 在装有过氧化氢溶液的试管中加入少量Al2O3,然后将带火星的木条伸入试管中 | 产生大量的气泡木条复燃 | 加入Al2O3能加快过氧化氢溶液的分解速率 加入Al2O3能加快过氧化氢溶液的分解速率 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实验步骤 | 实验现象 |
| Ⅰ.分别量取5mL 5%过氧化氢溶液放入A、B 两支试管中,向A试管中加入ag氧化铁粉末,并分别在A、B两支试管中插入带火星木条,观察现象. | A试管中产生气泡,带火星木条复燃,B试管中无明显现象 |
| Ⅱ.待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,如此反复多次试验,观察现象. | 试管中均产生气泡,带火星木条均复燃 |
| Ⅲ.将实验Ⅱ中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量,所得固体质量仍为ag. | |
| Ⅳ.分别量取5mL 5%过氧化氢溶液放入C、D 两支试管中,向C试管中加入ag氧化铁粉末,向D试管中加入ag二氧化锰粉末,观察现象. |
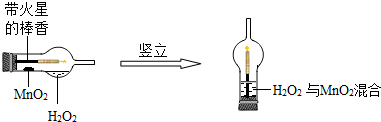
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 下面是实验室制取氧气的装置图,根据装置图回答下列问题:
下面是实验室制取氧气的装置图,根据装置图回答下列问题: ________管口通入瓶中;③若将瓶中装入半瓶蒸馏水可用于病人输送装置,________端连接贮氧气钢瓶,在输送的过程中,这一装置能起到的作用是________、________、________.
________管口通入瓶中;③若将瓶中装入半瓶蒸馏水可用于病人输送装置,________端连接贮氧气钢瓶,在输送的过程中,这一装置能起到的作用是________、________、________.| 实验步骤 | 实验现象 | 实验结论 | |
| 实验一 | ________ | 有少量气泡 木条不复燃 | 常温下过氧化氢溶液分解速率很慢. |
| 实验二 | 在装有过氧化氢溶液的试管中加入少量Al2O3,然后将带火星的木条伸入试管中 | 产生大量的气泡木条复燃 | ________ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com