
| 元素名称 | 钠 | 镁 | 铝 | 硅 | 磷 | 硫 | 氯 | 氩 |
| 元素符号 | Na | Mg | Al | Si | P | S | Cl | Ar |
| 原子结构示意图 |  | 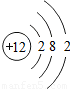 | 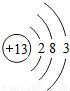 |  |  |  |  | 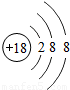 |
 SO2)可用图表示:
SO2)可用图表示:
 SO2),可知其各物质的质量关系;N个氧气分子的质量为32g,完全反应生成的二氧化硫分子数为N个;则可求则64g氧气与足量硫粉完全反应生成的二氧化硫分子数.
SO2),可知其各物质的质量关系;N个氧气分子的质量为32g,完全反应生成的二氧化硫分子数为N个;则可求则64g氧气与足量硫粉完全反应生成的二氧化硫分子数.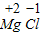 ,利用化合价数值交叉法书写化学式为:MgCl2;
,利用化合价数值交叉法书写化学式为:MgCl2; SO2),可知其各物质的质量关系;N个氧气分子的质量为32g,完全反应生成的二氧化硫分子数为N个;64g氧气含有2N个氧气分子,故64g氧气与足量硫粉完全反应生成的二氧化硫分子数为2N.
SO2),可知其各物质的质量关系;N个氧气分子的质量为32g,完全反应生成的二氧化硫分子数为N个;64g氧气含有2N个氧气分子,故64g氧气与足量硫粉完全反应生成的二氧化硫分子数为2N.

科目:初中化学 来源: 题型:
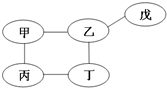 (2011?南通模拟)某同学在复习单质、氧化物、酸、碱、盐性质时,用铁、氧化铜、稀硫酸、氢氧化钠溶液、硫酸铜溶液五种物质,构建了如图所示的知识网络图(图中短线“-”表示相连的两种物质能在一定条件下发生反应).下列有关说法不正确的是( )
(2011?南通模拟)某同学在复习单质、氧化物、酸、碱、盐性质时,用铁、氧化铜、稀硫酸、氢氧化钠溶液、硫酸铜溶液五种物质,构建了如图所示的知识网络图(图中短线“-”表示相连的两种物质能在一定条件下发生反应).下列有关说法不正确的是( )查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:初中化学 来源:2011年江苏省南通市中考化学试卷(解析版) 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com