
| 硝酸铵(NH4NO3)净重:50Kg 含氮量≥31.5% ××化肥厂出品 |
 ×100%=35%;
×100%=35%; ×100%=90%,故每一袋这种化肥中NH4NO3的质量应不少于50Kg×90%=45Kg;
×100%=90%,故每一袋这种化肥中NH4NO3的质量应不少于50Kg×90%=45Kg;

 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:初中化学 来源:2008年江苏省扬州市初中毕业升学统一考试、化学试卷 题型:022
某化式厂为综合利用生产过程中的副产品CaSO4,与相邻的化肥厂联合设计了以下制备(NH4)2SO4的工艺流程:
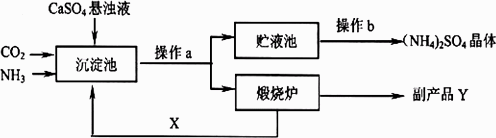
(1)上述流程中,沉淀池中发生的主要化学反应为:
CO2+2NH3+CaSO4+H2O=CaCO3+(NH4)2SO4,煅烧炉中发生的化学反应方程式为________.该工艺中可循环使用的X为________(填化学式,下同),副产品Y为________.
(2)操作a的名称是________,实验室中进行此操作时,用到的玻璃仪器除玻璃棒、烧杯外,还需要________,请说出该仪器的另一种用途________.操作b的过程是________、冷却、________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com