
分析 (a)含有碳元素的化合物叫有机化合物,简称有机物.
(b)物理性质是不需要发生化学变化就能表现出来的性质,包括物质的颜色、状态、气味、熔点、沸点、密度、溶解性等.
(c)根据题意,饮酒过量的人可以用食醋来解酒,因为乙酸能跟乙醇发生酯化反应生成乙酸乙酯(CH3COOC2H5)和水,从而达到解酒的目的.
(d)根据基本反应类型的判断方法来分析;
(e)铁属于活泼金属,能与醋酸反应生成醋酸亚铁和氢气.
解答 解:(a)乙酸是含碳元素的化合物,属于有机化合物.故填:有机化合物;
(b)由题干信息可知,醋酸是无色有刺激性气味液体,能溶于水,不需要通过化学变化就能表现出来,属于物理性质.故填:无色有刺激性气味液体,能溶于水;
(c)饮酒过量的人可以用食醋来解酒,因为乙酸能跟乙醇发生酯化反应生成乙酸乙酯(CH3COOC2H5)和水,从而达到解酒的目的.故填:乙酸能跟乙醇发生酯化反应生成乙酸乙酯和水,从而达到解酒的目的;
(d)除水垢的化学方程式为:CaCO3+2CH3COOH═(CH3COO)2Ca+H2O+CO2↑.该反应是由两种化合物相互交换成分生成两种新的化合物,属于复分解反应;故填:复分解;
(e)铁属于活泼金属,能与醋酸反应生成醋酸亚铁和氢气,可被人体吸收达到补铁的目的;故填:铁能与食醋反应生成可溶性的醋酸亚铁被人体吸收.
点评 本题难度不大,掌握酸的化学性质、有机物的特征、物理性质的特征、基本反应类型的判断方法等是正确解答本题的关键.


科目:初中化学 来源: 题型:选择题
| A. | H2SO4NaClNa2CO3CaCl2 | B. | HCl NaOHCuSO4 MgSO4 | ||
| C. | NaNO3HCl CaCl2KOH | D. | Na2CO3 K2SO4 BaCl2HCl |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
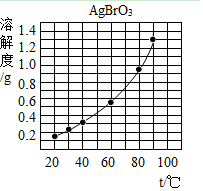 溴酸银(AgBrO3)的溶解度随温度变化曲线如图所示,下列说法不正确的是( )
溴酸银(AgBrO3)的溶解度随温度变化曲线如图所示,下列说法不正确的是( )| A. | 升高温度溴酸银的溶解度增大 | |
| B. | 40℃时溴酸银易溶于水 | |
| C. | 90℃时溴酸银溶液的溶质质量分数一定小于1.3% | |
| D. | 溴酸银可用降温结晶的方法从溶液中析出 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com