
| ||
| 80 |
| x |
| 18 |
| 1.8g |
| 64 |
| 64+16 |
| 10.0g-8.0g+6.4g |
| 10.0g |


 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案科目:初中化学 来源: 题型:

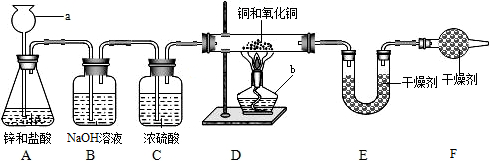
| 装置 | 反应前 | 反应后 |
| a | 试管的质量36.2g 氧化铜和炭粉混合物的质量为20.0g |
试管和固体物质的质量为54.8g |
| c | 反应后瓶内液体比反应前增重1.1g | |
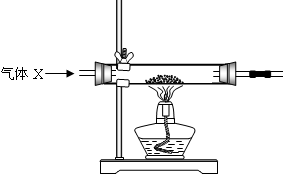
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
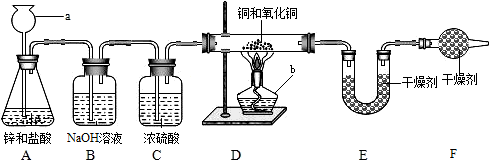
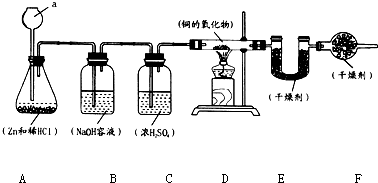 实验室用锌和稀盐酸制取氢气,并用氢气还原铜的一种氧化物的实验来测定该氧化物的组成.实验装置如图所示:
实验室用锌和稀盐酸制取氢气,并用氢气还原铜的一种氧化物的实验来测定该氧化物的组成.实验装置如图所示:7.2g-0.9g×
| ||
0.9g×
|
7.2g-0.9g×
| ||
0.9g×
|
查看答案和解析>>
科目:初中化学 来源: 题型:
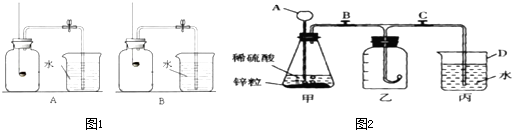
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com