
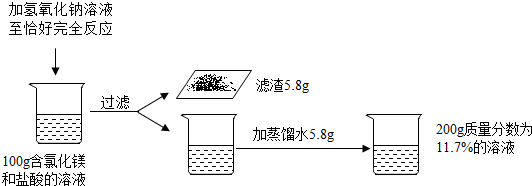
���� ��1��ʵ�����г������ɵķ�Ӧ���Ȼ�þ����������֮��ķ�Ӧ����������������þ���Ȼ��ƣ�
��2������MgCl2+2NaOH=Mg��OH��2��+2NaCl������������þ����5.8g�������
��3�������ڵμ�����������Һ�����������������������������ᷴӦ��϶������Ȼ�þ��Ӧ�Ĺ��ɷ�������
��4�����ݣ�2���б���ʽ�������
��5������Ԫ���غ���ɷ�������
��� �⣺
��1��ʵ�����г������ɵķ�Ӧ���Ȼ�þ����������֮��ķ�Ӧ����������������þ���Ȼ��ƣ�������Ӧ�Ļ�ѧ����ʽ�ǣ�MgCl2+2NaOH=Mg��OH��2��+2NaCl��
��2������MgCl2+2NaOH=Mg��OH��2��+2NaCl������������þ����5.8g�������
MgCl2+2NaOH=Mg��OH��2��+2NaCl��
95 58
x 5.8g
���Ը�����֪�����г����μӷ�Ӧ�Ȼ�þ������x���ı���ʽΪ��$\frac{95}{58}$=$\frac{x}{5.8g}$��
��3���ڵμ�����������Һ�����������������������������ᷴӦ��϶������Ȼ�þ��Ӧ���ڵμ�����������Һ�����������У��ձ��ڸ����ʵ������仯���Ϊ�����������ȼ�����0���Ȼ�þ�����������0���Ȼ���������0��������ֵ��
��4���⣨2���б���ʽ�ã�x=9.5g��
���Ȼ�þ���������Ʒ�Ӧ�����Ȼ��Ƶ�������y��
MgCl2+2NaOH=Mg��OH��2��+2NaCl��
95 117
9.5g y
$\frac{95}{9.5g}$=$\frac{117}{y}$��
���y=11.7g
����ձ����Ȼ������ʵ�����Ϊ��200g��11.7%=23.4g��
���ԣ��������������Ʒ�Ӧ���ɵ��Ȼ��Ƶ������ǣ�23.4g-11.7g=11.7g��
�����������Ʒ�Ӧ�������������z��
HCl+NaOH=H2O+NaCl��
36.5 58.5
z 11.7g
$\frac{36.5}{z}$=$\frac{58.5}{11.7g}$
���z=7.3g��
����ԭ�����Һ��MgCl2 ��HCl���������������Ϊ��9.5g��7.3g=95��73��
��5������������������Һ���ʵ�����Ϊm��
NaOH��NaCl��
40 58.5
m 23.4g
m=16g��
��������������Һ���ʵ���������=$\frac{16g}{200g-5.8g+5.8g-100g}$��100%=16%��
�������
��1��MgCl2+2NaOH=Mg��OH��2��+2NaCl��
��2��$\frac{95}{58}$=$\frac{x}{5.8g}$��
��3�����������ȼ�����0���Ȼ�þ�����������0���Ȼ���������0��������ֵ��
��4��95��73��
��5��16%��
���� �������⣬��©���ݣ����ļ����ǽ����֮�ؼ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ̼+����$\stackrel{��ȼ}{��}$������̼ | B�� | �Ȼ���+�������Ȼ�� | ||
| C�� | ̼�����$\stackrel{����}{��}$����+������̼+ˮ | D�� | �ƾ�+����$\stackrel{��ȼ}{��}$������̼+ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ̫���ܵ綯�����ڵ綯���Ļ����ϣ���̫����ת���ɵ��ܶԳ����й���ģ��ںܴ�̶��Ͻ����˵綯����ʹ�óɱ�����ʱ��Ч�ز���綯��Ұ����ʻ;�еĵ�������ش�����������⣺
̫���ܵ綯�����ڵ綯���Ļ����ϣ���̫����ת���ɵ��ܶԳ����й���ģ��ںܴ�̶��Ͻ����˵綯����ʹ�óɱ�����ʱ��Ч�ز���綯��Ұ����ʻ;�еĵ�������ش�����������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʳ�ú����ʳ�� | |
| B�� | ����ͷ������С�մ� | |
| C�� | �ü�ȩ��Һ���ݺ��� | |
| D�� | ʳƷ������뵪���ӳ�ʳƷ�ı����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
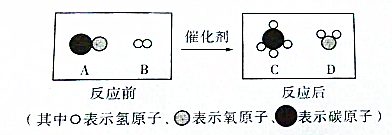
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com