
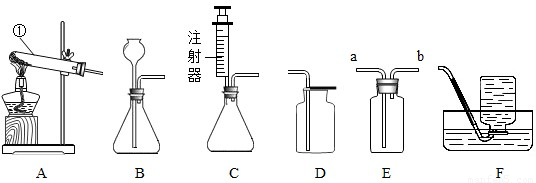
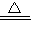 K2MnO4+MnO2+O2↑;装置C滴加液体的仪器是注射器,用注射器代替长颈漏斗,可以使滴加的液体随加随停,控制产生气体的速率,同时节约药品;
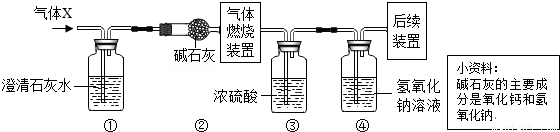
K2MnO4+MnO2+O2↑;装置C滴加液体的仪器是注射器,用注射器代替长颈漏斗,可以使滴加的液体随加随停,控制产生气体的速率,同时节约药品;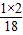 ×100%=0.2g;装置④增重2.2 g,说明生成了2.2g二氧化碳,碳元素的质量为2.2g×
×100%=0.2g;装置④增重2.2 g,说明生成了2.2g二氧化碳,碳元素的质量为2.2g×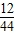 ×100%=0.6g,气体X中C:H=0.6g:0.2g=3:1;CH4中C:H=12:4=3:1;故X的组成可能是①只有甲烷,②可能含有氢气和一氧化碳,③可能同时含有甲烷、氢气和一氧化碳.通过以上分析,此项错误;
×100%=0.6g,气体X中C:H=0.6g:0.2g=3:1;CH4中C:H=12:4=3:1;故X的组成可能是①只有甲烷,②可能含有氢气和一氧化碳,③可能同时含有甲烷、氢气和一氧化碳.通过以上分析,此项错误; K2MnO4+MnO2+O2↑;节约药品;可以控制滴加液体的速度,进而控制反应速率;
K2MnO4+MnO2+O2↑;节约药品;可以控制滴加液体的速度,进而控制反应速率;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源:期中题 题型:实验题
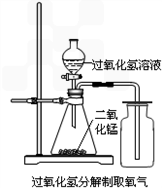
查看答案和解析>>
科目:初中化学 来源:同步题 题型:实验题
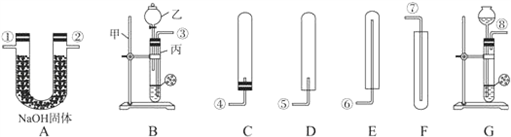
查看答案和解析>>
科目:初中化学 来源:江苏中考真题 题型:填空题
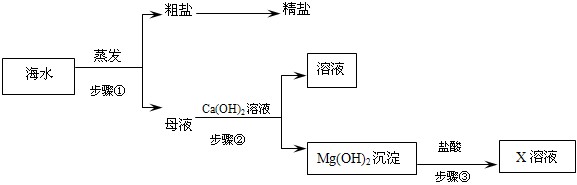
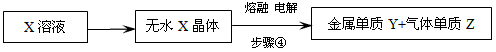
查看答案和解析>>
科目:初中化学 来源:《9.1 化学与能源开发》2006-2007年同步测控优化30分钟训练(解析版) 题型:填空题
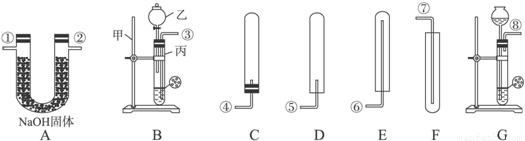
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com